文章标题
研究设计
本研究纳入队列包括255名成人和26名儿童(脓毒症患者及对照),采集外周血单核细胞(PBMCs)和血浆开展多组学检测分析。
多组学技术包括:
(1)单细胞RNA测序(scRNA-seq)用于细胞分群和转录组分析。
(2)scTCR/BCR测序解析T细胞和B细胞受体库的克隆多样性。
(3)CITE-seq联合表面蛋白检测验证细胞表型。
(4)血浆蛋白质组学量化92种炎症相关蛋白。
验证方法:通过外部单细胞和转录组测序数据集、流式细胞术、RT-PCR、ELISA及小鼠模型(如Nr4a2基因敲除和过表达模型)验证关键发现。
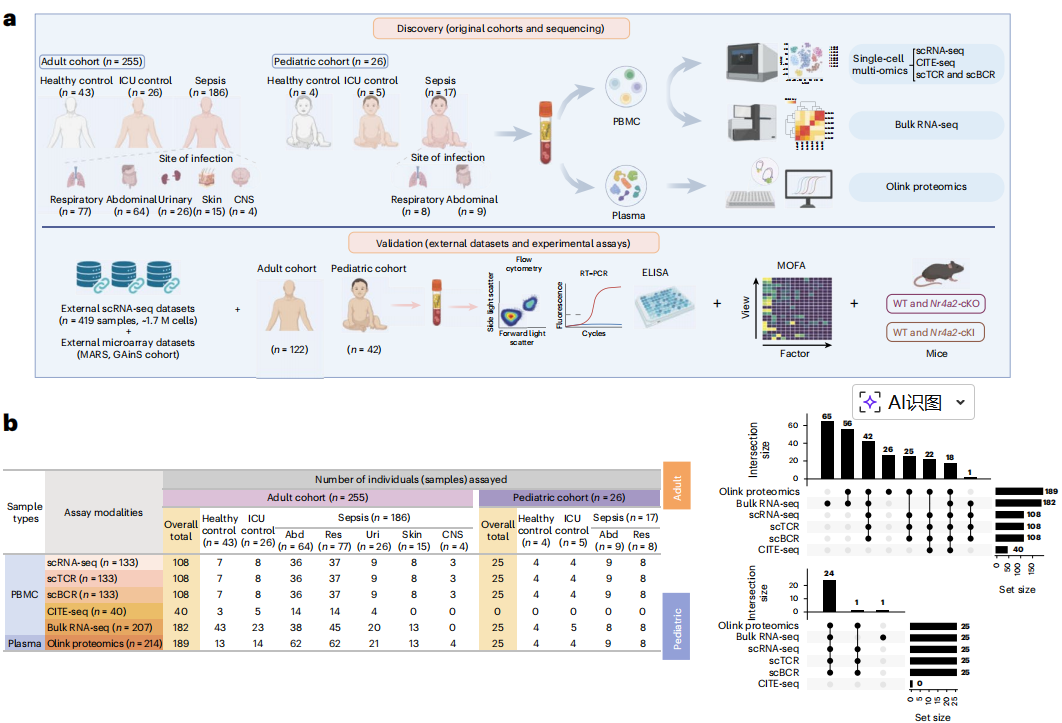
Fig.1 研究概述
研究结论
1. 脓毒症患者免疫细胞亚群和异质性特征
通过单细胞转录组数据,以及单细胞T细胞受体(scTCR)和单细胞B细胞受体(scBCR)谱分析,鉴定出44个细胞亚群(Fig.2c),包括T细胞(CD4⁺、CD8⁺)、B细胞、髓系细胞、NK细胞等。通过对细胞类型比例进行定量分析(Fig.2d, 2e)显示成人脓毒症中CD8⁺T细胞和NK细胞减少,儿童肺部脓毒症中CD4⁺T细胞比例降低。

Fig.2 整体免疫细胞景观
2. 脓毒症中不同解剖来源的CD4⁺T细胞异质性
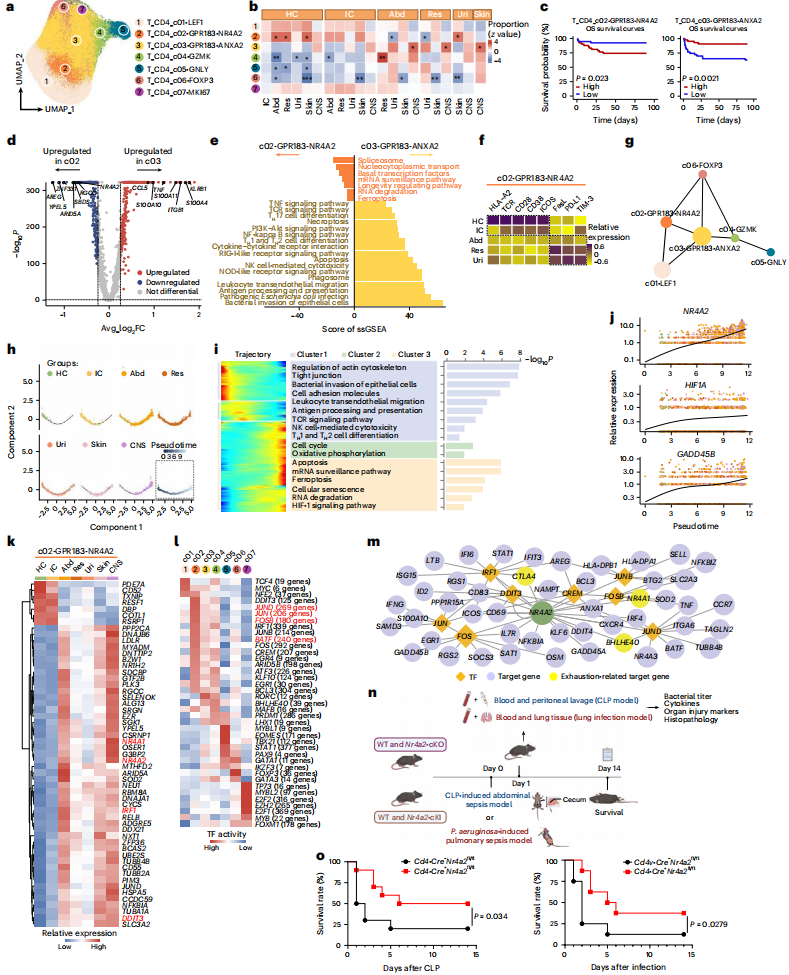
Fig.3 不同解剖学来源的脓毒症成人患者CD4⁺T细胞亚群的异质性
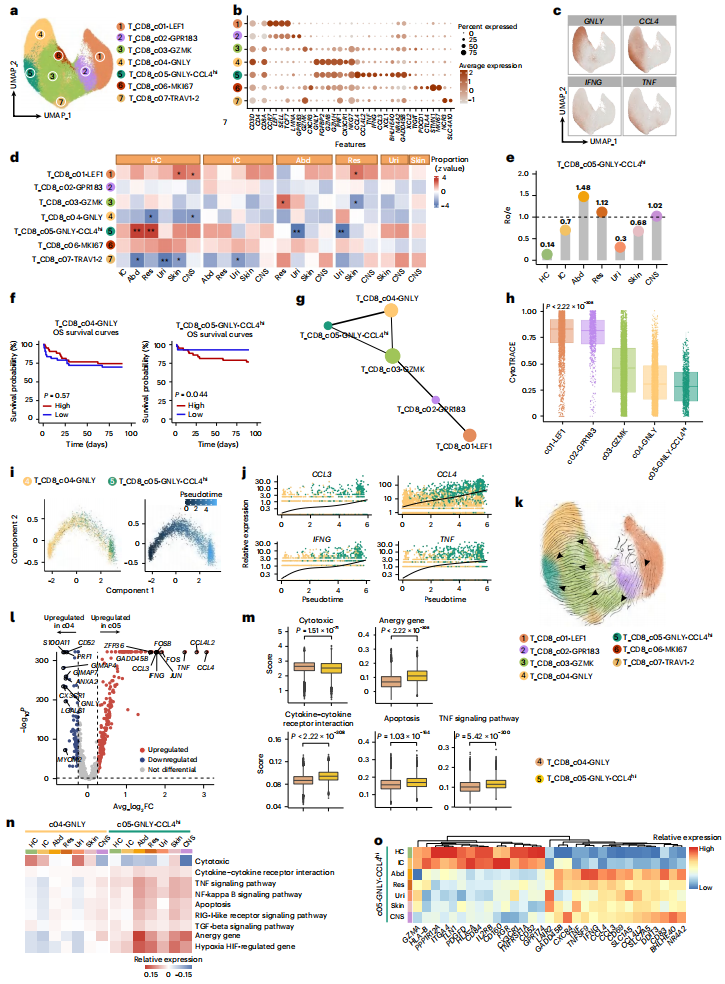
Fig.4 GNLY-CCL4ʰⁱ促炎性CD8⁺T细胞亚群在腹部和呼吸道感染诱导的脓毒症中的扩张

Fig.5 成人脓毒症中单核细胞亚群在不同感染源中的功能谱差异
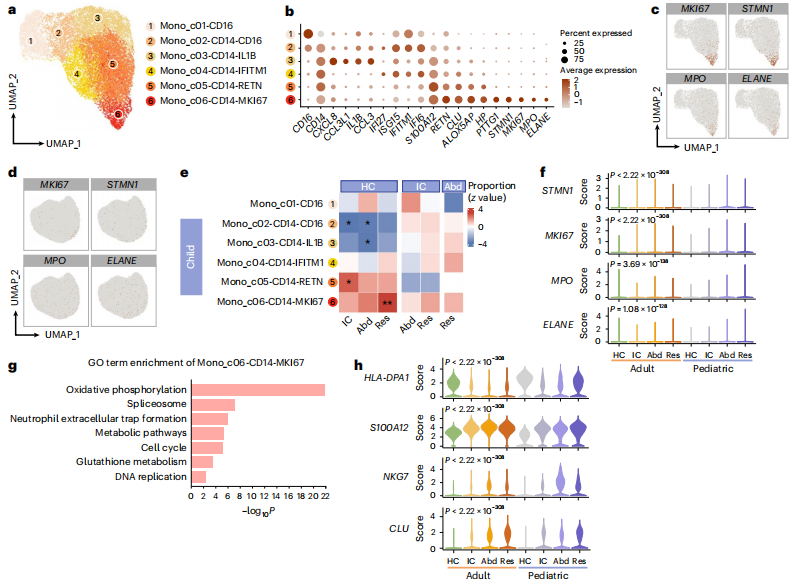
Fig.6 儿童脓毒症中单核细胞亚群在不同感染源中的功能谱差异

Fig.7 蛋白质组学分析揭示了成人与儿童脓毒症中独特且共有的蛋白质表达谱

Fig.8 在外部单细胞RNA测序数据集及独立队列中验证关键免疫细胞亚群

文章标题
研究设计
本研究纳入队列包括255名成人和26名儿童(脓毒症患者及对照),采集外周血单核细胞(PBMCs)和血浆开展多组学检测分析。
多组学技术包括:
(1)单细胞RNA测序(scRNA-seq)用于细胞分群和转录组分析。
(2)scTCR/BCR测序解析T细胞和B细胞受体库的克隆多样性。
(3)CITE-seq联合表面蛋白检测验证细胞表型。
(4)血浆蛋白质组学量化92种炎症相关蛋白。
验证方法:通过外部单细胞和转录组测序数据集、流式细胞术、RT-PCR、ELISA及小鼠模型(如Nr4a2基因敲除和过表达模型)验证关键发现。

Fig.1 研究概述
研究结论
1. 脓毒症患者免疫细胞亚群和异质性特征
通过单细胞转录组数据,以及单细胞T细胞受体(scTCR)和单细胞B细胞受体(scBCR)谱分析,鉴定出44个细胞亚群(Fig.2c),包括T细胞(CD4⁺、CD8⁺)、B细胞、髓系细胞、NK细胞等。通过对细胞类型比例进行定量分析(Fig.2d, 2e)显示成人脓毒症中CD8⁺T细胞和NK细胞减少,儿童肺部脓毒症中CD4⁺T细胞比例降低。

Fig.2 整体免疫细胞景观
2. 脓毒症中不同解剖来源的CD4⁺T细胞异质性

Fig.3 不同解剖学来源的脓毒症成人患者CD4⁺T细胞亚群的异质性

Fig.4 GNLY-CCL4ʰⁱ促炎性CD8⁺T细胞亚群在腹部和呼吸道感染诱导的脓毒症中的扩张

Fig.5 成人脓毒症中单核细胞亚群在不同感染源中的功能谱差异

Fig.6 儿童脓毒症中单核细胞亚群在不同感染源中的功能谱差异

Fig.7 蛋白质组学分析揭示了成人与儿童脓毒症中独特且共有的蛋白质表达谱

Fig.8 在外部单细胞RNA测序数据集及独立队列中验证关键免疫细胞亚群