文献目录
01 (J HEPATOL) 巨噬细胞来源的组织蛋白酶 B 通过降解 occludin 破坏肠道紧密连接并促进酒精相关性肝病发生
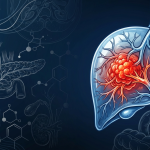
02 (NAT METAB) 进食调控的糖原代谢驱动肝脏蛋白分泌的昼夜节律性
03 (ACS NANO) 基于无细胞合成的最小化细胞外囊泡仿生体原型构建
04 (NAT COMMUN) 尿簇集蛋白作为人类肾脏疾病进展及内皮素受体拮抗剂阿曲生坦治疗反应的生物标志物:基于 SONAR 研究的探索性分析
05 (NAT COMMUN) 哺乳动物全血中的自由基蛋白足迹分析
06 (CLIN MOL HEPATOL) MTARC1 p.A165 位点失活抑制肝细胞癌在体外和体内的侵袭性
07 (PROTEIN CELL) 食管鳞状细胞癌多组学研究进展:从诊断、预后与治疗视角出发
一起来看看本期的蛋白质组学精选优质文献吧!

1. (J HEPATOL,IF: 33) 巨噬细胞来源的组织蛋白酶 B 通过降解 occludin 破坏肠道紧密连接并促进酒精相关性肝病发生
2026年2月7日,美国加利福尼亚大学圣地亚哥分校医学院联合多中心团队在 Journal of Hepatology发表了题为 Macrophage-derived cathepsin B disrupts intestinal tight junctions through occludin degradation and promotes alcohol-associated liver disease的研究,聚焦巨噬细胞来源的组织蛋白酶 B 在酒精相关性肝病中的作用。
肠道屏障功能受损可促进肠源性微生物及其产物向肝脏转移,是酒精相关性肝炎发生和进展的重要驱动因素,但其具体分子机制尚未完全阐明。本研究基于多中心队列的粪便蛋白质组学分析发现,随着酒精使用障碍进展为酒精相关性肝炎,粪便中组织蛋白酶 B 水平逐渐升高,且其升高与患者较高的短期死亡风险显著相关;该蛋白酶主要由肠道巨噬细胞表达,并可被乙醇刺激上调。在慢性叠加暴饮乙醇喂养的小鼠模型中,髓系细胞缺失组织蛋白酶 B 或口服肠道限制性的组织蛋白酶 B 抑制剂 CA074,均可通过保护紧密连接蛋白 occludin 稳定肠道屏障,降低血清脂多糖水平,并显著减轻乙醇诱导的脂肪性肝炎;而在肠道上皮细胞中过表达 occludin 同样能够缓解肝脏损伤。机制研究进一步表明,组织蛋白酶 B 可特异性切割 occludin 的胞外结构域,其抑制能够防止 occludin 降解及随之发生的肠道屏障破坏。综上,研究明确了“乙醇–肠道巨噬细胞–组织蛋白酶 B–occludin”这一致病轴在酒精相关性肝病中的关键作用,并提出组织蛋白酶 B 作为潜在治疗靶点的可能性。
原文链接: https://pubmed.ncbi.nlm.nih.gov/41654223/

2. (NAT METAB,IF: 20.8) 进食调控的糖原代谢驱动肝脏蛋白分泌的昼夜节律性
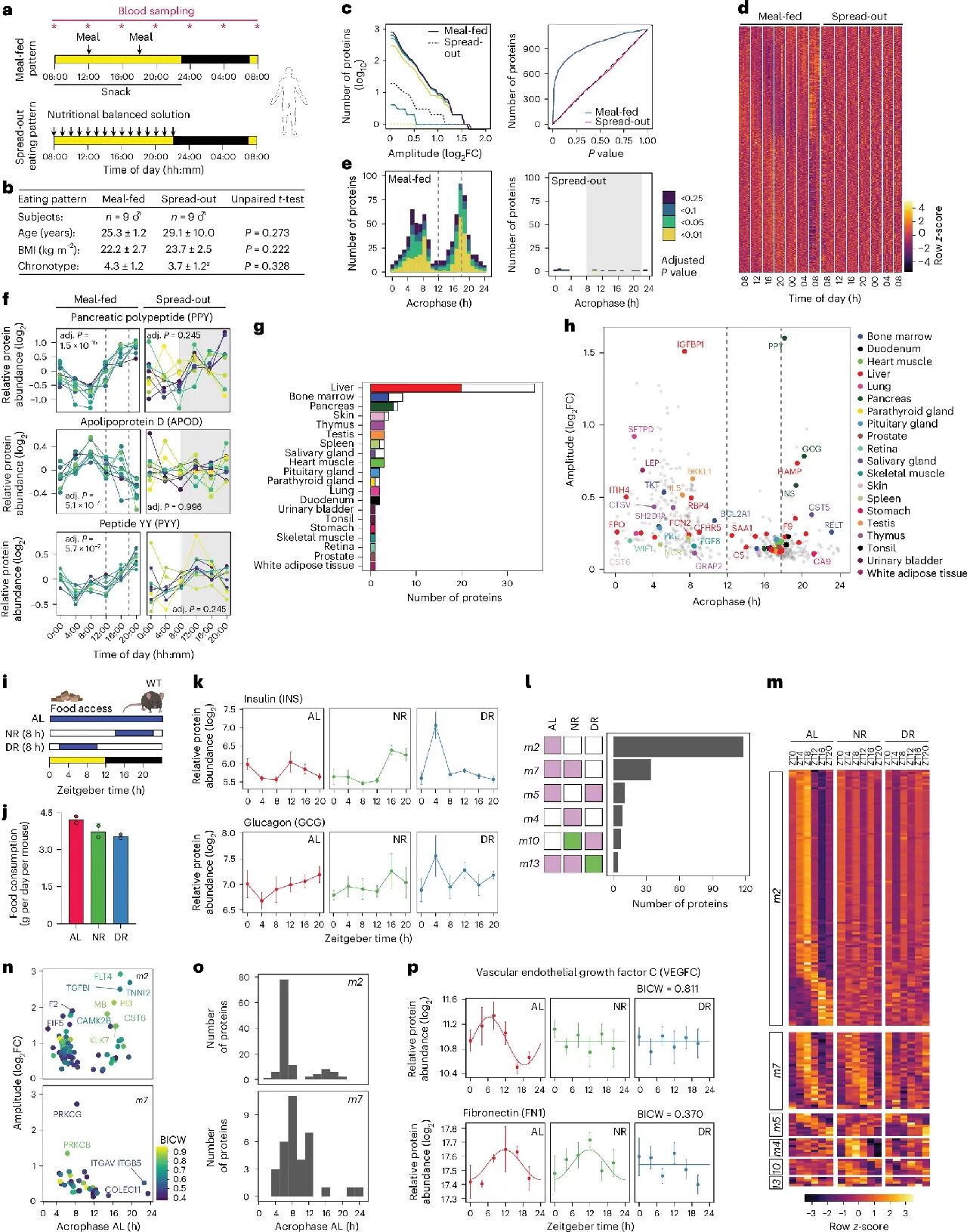

3. (ACS NANO,IF: 15.8) 基于无细胞合成的最小化细胞外囊泡仿生体原型构建
2026 年 2 月 5 日,加州大学戴维斯分校工程学院联合多家研究团队在 ACS Nano 发表题为 Prototyping Minimal Extracellular Vesicle Mimetics Using Cell-Free Synthesis 的研究工作,提出了一种基于无细胞蛋白合成的最小细胞外囊泡(extracellular vesicle, EV)仿生体构建策略,旨在系统解析 EV 表面蛋白与其功能之间的关系。
细胞外囊泡表面富含多种蛋白,这些蛋白赋予 EV 靶向特定受体细胞并调控细胞响应的能力。然而,由于天然 EV 表面蛋白组成高度异质,长期以来难以将单一表面蛋白与特定生物学功能明确对应。针对这一挑战,研究团队开发了一种自下而上的无细胞蛋白合成平台——VESSEL(Vesicle Engineering Systems using Synthetic Expression and Loading),用于构建可控展示不同 EV 表面蛋白结构域的人工纳米囊泡(artificial nanovesicles, ANVs)。
该平台基于胎盘来源间充质干细胞天然 EV 的蛋白质组学数据筛选候选表面蛋白,并利用以细菌膜蛋白 Aquaporin-Z 为核心的膜锚定系统,实现了 39 种 EV 表面蛋白结构域在 ANVs 表面的无细胞合成与展示,合成效率超过每微升 10⁸ 个 ANVs。研究者通过单囊泡流式细胞术、超分辨显微成像以及基于囊泡的 ELISA 等多种高分辨率手段,对 ANVs 的组成与表面蛋白展示情况进行了系统表征。
在功能层面,研究评估了不同 EV 表面蛋白对 HEK293FT 细胞摄取效率的影响,发现包括 CADM1 和 NPTN 在内的多种此前未被关注的蛋白可显著增强细胞摄取能力;在神经保护相关实验中,部分表面蛋白还显著促进了 SH-SY5Y 细胞的神经突生长。
总体而言,该研究建立了一种高通量、模块化的无细胞 EV 仿生体构建平台,为系统解析 EV 表面蛋白作为“信号载体”的功能提供了有力工具,并为理性设计具有明确定义生物学功能的 EV 仿生体系奠定了基础。
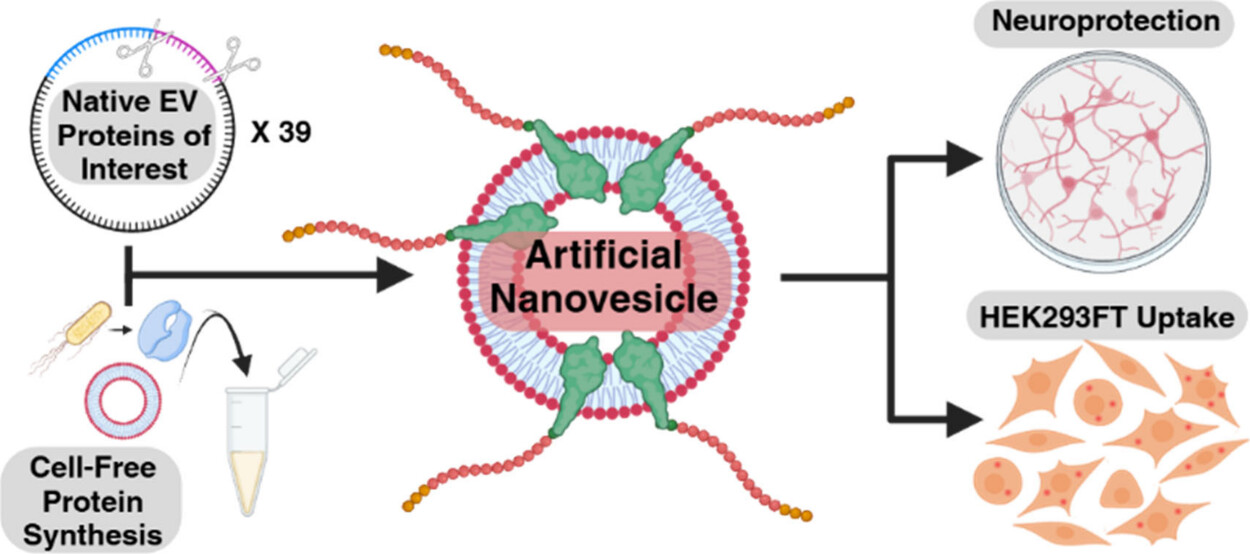

4. (NAT COMMUN,IF: 15.7) 尿簇集蛋白作为人类肾脏疾病进展及内皮素受体拮抗剂阿曲生坦治疗反应的生物标志物:基于 SONAR 研究的探索性分析
2026年2月7日,SONAR随机对照试验研究团队联合多家国际学术与临床研究机构(SONAR trial investigators 等)在 Nature Communications 发表题为 Urinary clusterin as a biomarker of human kidney disease progression and response to the endothelin receptor antagonist atrasentan 的研究,系统评估了尿液 clusterin(urinary clusterin, uCLU)作为糖尿病相关慢性肾病(CKD)进展及内皮素受体拮抗剂 atrasentan 治疗反应生物标志物的潜在价值。
在 2 型糖尿病合并慢性肾病患者中,内皮素受体拮抗剂 atrasentan 已在 SONAR 临床试验中被证实可改善肾脏结局,但患者间疗效差异显著,亟需可预测疾病进展和治疗反应的分子标志物。为此,研究者在 SONAR 试验人群中开展了嵌套病例–对照蛋白质组学分析(N = 180),从而鉴定出 uCLU 作为最具潜力的候选指标。
进一步在独立人群的肾活检样本中进行的组织学与单细胞转录组分析显示,CLU mRNA 水平升高与肾功能持续恶化及不良临床预后显著相关;在糖尿病肾病小鼠模型中,atrasentan 治疗可显著降低内皮素信号通路的激活评分,支持其作用机制的生物学一致性。
在完整 SONAR 队列(N = 3,060)中,基线 uCLU 水平越高,患者的肾脏结局越差;同时,atrasentan 治疗 6 周可使 uCLU 水平降低 42.6%,且 uCLU 的早期下降可独立预测患者长期肾脏获益。
总体而言,该研究表明尿液 clusterin 与糖尿病相关慢性肾病的进展及 atrasentan 的治疗反应密切相关,支持 uCLU 作为药效学监测及精准分层治疗的潜在临床生物标志物。

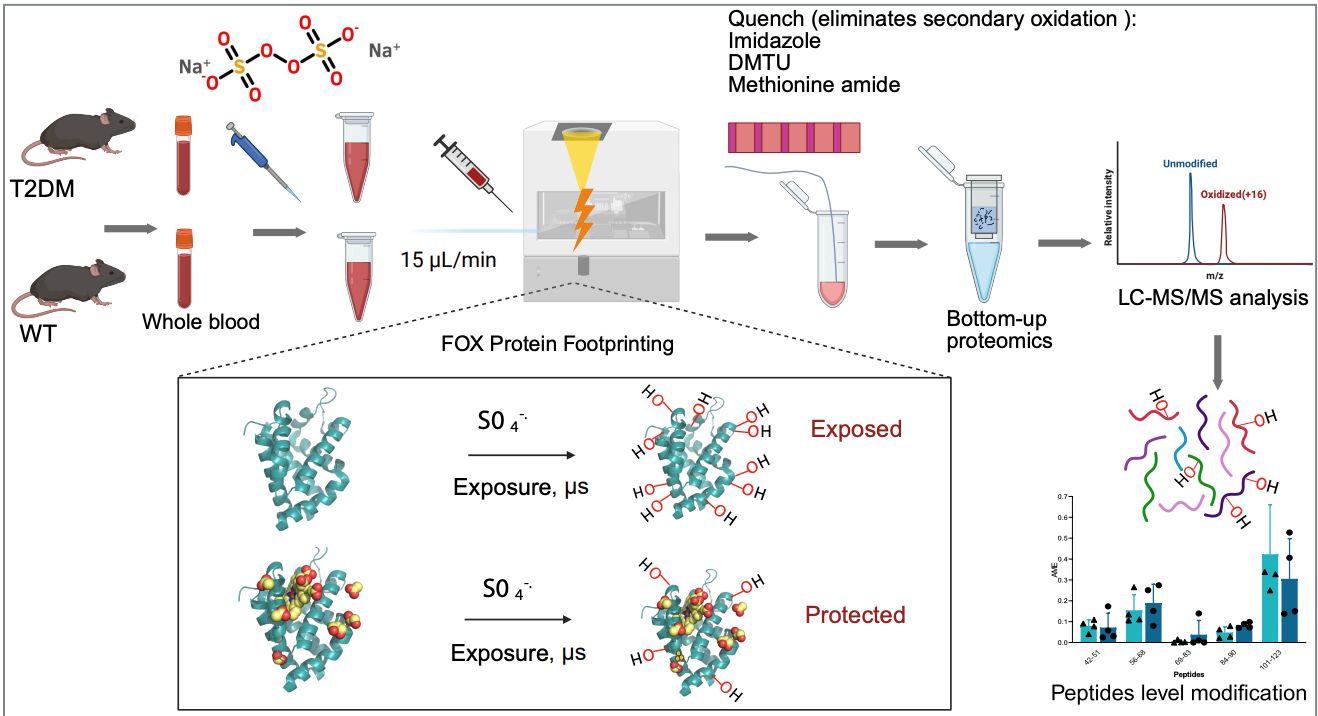
5. (NAT COMMUN,IF: 15.7) 哺乳动物全血中的自由基蛋白足迹分析
2026年2月7日,国际结构蛋白质组学研究团队在 Nature Communications 发表题为 Radical footprinting in mammalian whole blood 的研究,首次将自由基蛋白足迹(radical protein footprinting, RPF)技术成功应用于活体哺乳动物全血体系,并用于解析 2 型糖尿病相关的蛋白质构象变化。
羟基自由基蛋白足迹技术是一种解析蛋白质高级结构及蛋白–蛋白、蛋白–配体相互作用的有力工具,但其应用长期受限于体外体系。尽管近年来该技术已逐步拓展至活细胞、线虫及三维培养模型,在活体哺乳动物组织和复杂生物体中的应用仍未实现。
在本研究中,研究者首次在野生型及 2 型糖尿病小鼠的全血样本中建立了稳定可行的 RPF 方法。通过采用 FOX 光解体系激活过硫酸盐,在不显著破坏血细胞形态的前提下实现了高效的蛋白氧化标记,并结合优化的淬灭流程,有效消除了背景氧化信号。
基于该体系,研究鉴定了血液中丰度最高的 11 种蛋白的氧化修饰位点,揭示了多种与疾病状态相关的蛋白构象变化;进一步分析表明,RPF 可灵敏检测补体激活以及转铁蛋白铁饱和度升高所引发的结构改变。
总体而言,该研究验证了自由基蛋白足迹技术在哺乳动物全血体系中的可行性与稳定性,为在临床样本和疾病模型中开展原位结构蛋白质组学研究提供了新的技术路径。

6. (CLIN MOL HEPATOL,IF: 8.9) MTARC1 p.A165 位点失活抑制肝细胞癌在体外和体内的侵袭性
2026年2月5日,来自欧洲多家肝病与代谢研究机构的研究团队在 Clinical and Molecular Hepatology发表了题为 MTARC1 p.A165 ablation reduces hepatocellular carcinoma aggressiveness in vitro and in vivo的研究,系统探讨了线粒体酶 MTARC1 在肝细胞癌发生发展中的功能作用。
该研究聚焦此前被发现具有肝病保护效应的 MTARC1 常见错义变异位点 p.A165(rs2642438)。研究者在多种携带 p.A165 等位基因的人源肝癌细胞系中,通过 siRNA 敲低和 CRISPR-Cas9 稳定敲除 MTARC1,系统评估其对肿瘤细胞增殖、迁移、脂质代谢和脂肪酸 β-氧化的影响,并在皮下异种移植小鼠模型中验证体内效应。结果显示,MTARC1 p.A165 的下调显著抑制肝癌细胞增殖与迁移,减少中性脂质在细胞内的积累,同时增强脂肪酸 β-氧化;在体内模型中,MTARC1 缺失显著降低肿瘤体积。蛋白质组学数据分析表明,无论在体外细胞还是体内肿瘤中,MTARC1 缺失均伴随促肿瘤信号通路的抑制和抗增殖蛋白的激活。总体而言,该研究揭示了 MTARC1 p.A165 在调控肝癌脂质代谢和肿瘤侵袭性中的关键作用,提示 MTARC1 可能成为肝细胞癌具有代谢基础的潜在治疗靶点。
原文链接:https://e-cmh.org/journal/view.php?doi=10.3350/cmh.2025.1261

7. (PROTEIN CELL,IF:13.6) 食管鳞状细胞癌多组学研究进展:从诊断、预后与治疗视角出发
2026年2月4日,郑州大学胸科医院等中国食管癌多组学研究团队在 Protein & Cell发表了题为 Advances in multi-omics for esophageal squamous cell carcinoma: Diagnostic, prognostic, and therapeutic perspectives的综述文章,系统总结了多组学技术在食管鳞状细胞癌(ESCC)诊断、预后和治疗策略开发中的最新进展。
这篇综述指出,尽管放疗、化疗和免疫治疗取得了一定进展,食管鳞状细胞癌因其显著的个体间及肿瘤内异质性仍预后不良,因此迫切需要基于分子层面的诊断和治疗策略。高通量组学技术——包括基因组学、转录组学、蛋白质组学和代谢组学——已极大推动了对 ESCC 生物学的理解:基因组分析揭示了如 TP53、NOTCH1 等反复改变及 PIK3CA、FGFR1、SOX2 等可施治扩增事件,表观基因组和转录组研究发现了基于甲基化的早期检测标志物和与免疫治疗反应及预后相关的转录型亚型,蛋白质组与代谢组分析则揭示了细胞周期、剪接体通路激活及乳酸代谢改变等新的生物标志物和治疗线索。尽管这些多组学发现为精准诊疗提供了理论基础,但临床转化仍面临分析流程标准化不足、多中心验证有限以及数据整合成本与复杂性高等挑战;未来整合人工智能与多组学数据的研究有望提高诊断精度并推动更精细的治疗决策。
原文链接: https://pubmed.ncbi.nlm.nih.gov/41639002/
声明:本文内容基于期刊公开信息整理,中文解读及科普文字由多个AI 助手生成,旨在帮助大众快速理解前沿研究,不构成任何专业建议或诊断依据。如需实验或临床应用,请以原始文献与专业人士意见为准。
文献目录
01 (J HEPATOL) 巨噬细胞来源的组织蛋白酶 B 通过降解 occludin 破坏肠道紧密连接并促进酒精相关性肝病发生
02 (NAT METAB) 进食调控的糖原代谢驱动肝脏蛋白分泌的昼夜节律性
03 (ACS NANO) 基于无细胞合成的最小化细胞外囊泡仿生体原型构建
04 (NAT COMMUN) 尿簇集蛋白作为人类肾脏疾病进展及内皮素受体拮抗剂阿曲生坦治疗反应的生物标志物:基于 SONAR 研究的探索性分析
05 (NAT COMMUN) 哺乳动物全血中的自由基蛋白足迹分析
06 (CLIN MOL HEPATOL) MTARC1 p.A165 位点失活抑制肝细胞癌在体外和体内的侵袭性
07 (PROTEIN CELL) 食管鳞状细胞癌多组学研究进展:从诊断、预后与治疗视角出发
一起来看看本期的蛋白质组学精选优质文献吧!

1. (J HEPATOL,IF: 33) 巨噬细胞来源的组织蛋白酶 B 通过降解 occludin 破坏肠道紧密连接并促进酒精相关性肝病发生
2026年2月7日,美国加利福尼亚大学圣地亚哥分校医学院联合多中心团队在 Journal of Hepatology发表了题为 Macrophage-derived cathepsin B disrupts intestinal tight junctions through occludin degradation and promotes alcohol-associated liver disease的研究,聚焦巨噬细胞来源的组织蛋白酶 B 在酒精相关性肝病中的作用。
肠道屏障功能受损可促进肠源性微生物及其产物向肝脏转移,是酒精相关性肝炎发生和进展的重要驱动因素,但其具体分子机制尚未完全阐明。本研究基于多中心队列的粪便蛋白质组学分析发现,随着酒精使用障碍进展为酒精相关性肝炎,粪便中组织蛋白酶 B 水平逐渐升高,且其升高与患者较高的短期死亡风险显著相关;该蛋白酶主要由肠道巨噬细胞表达,并可被乙醇刺激上调。在慢性叠加暴饮乙醇喂养的小鼠模型中,髓系细胞缺失组织蛋白酶 B 或口服肠道限制性的组织蛋白酶 B 抑制剂 CA074,均可通过保护紧密连接蛋白 occludin 稳定肠道屏障,降低血清脂多糖水平,并显著减轻乙醇诱导的脂肪性肝炎;而在肠道上皮细胞中过表达 occludin 同样能够缓解肝脏损伤。机制研究进一步表明,组织蛋白酶 B 可特异性切割 occludin 的胞外结构域,其抑制能够防止 occludin 降解及随之发生的肠道屏障破坏。综上,研究明确了“乙醇–肠道巨噬细胞–组织蛋白酶 B–occludin”这一致病轴在酒精相关性肝病中的关键作用,并提出组织蛋白酶 B 作为潜在治疗靶点的可能性。
原文链接: https://pubmed.ncbi.nlm.nih.gov/41654223/

2. (NAT METAB,IF: 20.8) 进食调控的糖原代谢驱动肝脏蛋白分泌的昼夜节律性


3. (ACS NANO,IF: 15.8) 基于无细胞合成的最小化细胞外囊泡仿生体原型构建
2026 年 2 月 5 日,加州大学戴维斯分校工程学院联合多家研究团队在 ACS Nano 发表题为 Prototyping Minimal Extracellular Vesicle Mimetics Using Cell-Free Synthesis 的研究工作,提出了一种基于无细胞蛋白合成的最小细胞外囊泡(extracellular vesicle, EV)仿生体构建策略,旨在系统解析 EV 表面蛋白与其功能之间的关系。
细胞外囊泡表面富含多种蛋白,这些蛋白赋予 EV 靶向特定受体细胞并调控细胞响应的能力。然而,由于天然 EV 表面蛋白组成高度异质,长期以来难以将单一表面蛋白与特定生物学功能明确对应。针对这一挑战,研究团队开发了一种自下而上的无细胞蛋白合成平台——VESSEL(Vesicle Engineering Systems using Synthetic Expression and Loading),用于构建可控展示不同 EV 表面蛋白结构域的人工纳米囊泡(artificial nanovesicles, ANVs)。
该平台基于胎盘来源间充质干细胞天然 EV 的蛋白质组学数据筛选候选表面蛋白,并利用以细菌膜蛋白 Aquaporin-Z 为核心的膜锚定系统,实现了 39 种 EV 表面蛋白结构域在 ANVs 表面的无细胞合成与展示,合成效率超过每微升 10⁸ 个 ANVs。研究者通过单囊泡流式细胞术、超分辨显微成像以及基于囊泡的 ELISA 等多种高分辨率手段,对 ANVs 的组成与表面蛋白展示情况进行了系统表征。
在功能层面,研究评估了不同 EV 表面蛋白对 HEK293FT 细胞摄取效率的影响,发现包括 CADM1 和 NPTN 在内的多种此前未被关注的蛋白可显著增强细胞摄取能力;在神经保护相关实验中,部分表面蛋白还显著促进了 SH-SY5Y 细胞的神经突生长。
总体而言,该研究建立了一种高通量、模块化的无细胞 EV 仿生体构建平台,为系统解析 EV 表面蛋白作为“信号载体”的功能提供了有力工具,并为理性设计具有明确定义生物学功能的 EV 仿生体系奠定了基础。


4. (NAT COMMUN,IF: 15.7) 尿簇集蛋白作为人类肾脏疾病进展及内皮素受体拮抗剂阿曲生坦治疗反应的生物标志物:基于 SONAR 研究的探索性分析
2026年2月7日,SONAR随机对照试验研究团队联合多家国际学术与临床研究机构(SONAR trial investigators 等)在 Nature Communications 发表题为 Urinary clusterin as a biomarker of human kidney disease progression and response to the endothelin receptor antagonist atrasentan 的研究,系统评估了尿液 clusterin(urinary clusterin, uCLU)作为糖尿病相关慢性肾病(CKD)进展及内皮素受体拮抗剂 atrasentan 治疗反应生物标志物的潜在价值。
在 2 型糖尿病合并慢性肾病患者中,内皮素受体拮抗剂 atrasentan 已在 SONAR 临床试验中被证实可改善肾脏结局,但患者间疗效差异显著,亟需可预测疾病进展和治疗反应的分子标志物。为此,研究者在 SONAR 试验人群中开展了嵌套病例–对照蛋白质组学分析(N = 180),从而鉴定出 uCLU 作为最具潜力的候选指标。
进一步在独立人群的肾活检样本中进行的组织学与单细胞转录组分析显示,CLU mRNA 水平升高与肾功能持续恶化及不良临床预后显著相关;在糖尿病肾病小鼠模型中,atrasentan 治疗可显著降低内皮素信号通路的激活评分,支持其作用机制的生物学一致性。
在完整 SONAR 队列(N = 3,060)中,基线 uCLU 水平越高,患者的肾脏结局越差;同时,atrasentan 治疗 6 周可使 uCLU 水平降低 42.6%,且 uCLU 的早期下降可独立预测患者长期肾脏获益。
总体而言,该研究表明尿液 clusterin 与糖尿病相关慢性肾病的进展及 atrasentan 的治疗反应密切相关,支持 uCLU 作为药效学监测及精准分层治疗的潜在临床生物标志物。


5. (NAT COMMUN,IF: 15.7) 哺乳动物全血中的自由基蛋白足迹分析
2026年2月7日,国际结构蛋白质组学研究团队在 Nature Communications 发表题为 Radical footprinting in mammalian whole blood 的研究,首次将自由基蛋白足迹(radical protein footprinting, RPF)技术成功应用于活体哺乳动物全血体系,并用于解析 2 型糖尿病相关的蛋白质构象变化。
羟基自由基蛋白足迹技术是一种解析蛋白质高级结构及蛋白–蛋白、蛋白–配体相互作用的有力工具,但其应用长期受限于体外体系。尽管近年来该技术已逐步拓展至活细胞、线虫及三维培养模型,在活体哺乳动物组织和复杂生物体中的应用仍未实现。
在本研究中,研究者首次在野生型及 2 型糖尿病小鼠的全血样本中建立了稳定可行的 RPF 方法。通过采用 FOX 光解体系激活过硫酸盐,在不显著破坏血细胞形态的前提下实现了高效的蛋白氧化标记,并结合优化的淬灭流程,有效消除了背景氧化信号。
基于该体系,研究鉴定了血液中丰度最高的 11 种蛋白的氧化修饰位点,揭示了多种与疾病状态相关的蛋白构象变化;进一步分析表明,RPF 可灵敏检测补体激活以及转铁蛋白铁饱和度升高所引发的结构改变。
总体而言,该研究验证了自由基蛋白足迹技术在哺乳动物全血体系中的可行性与稳定性,为在临床样本和疾病模型中开展原位结构蛋白质组学研究提供了新的技术路径。


6. (CLIN MOL HEPATOL,IF: 8.9) MTARC1 p.A165 位点失活抑制肝细胞癌在体外和体内的侵袭性
2026年2月5日,来自欧洲多家肝病与代谢研究机构的研究团队在 Clinical and Molecular Hepatology发表了题为 MTARC1 p.A165 ablation reduces hepatocellular carcinoma aggressiveness in vitro and in vivo的研究,系统探讨了线粒体酶 MTARC1 在肝细胞癌发生发展中的功能作用。
该研究聚焦此前被发现具有肝病保护效应的 MTARC1 常见错义变异位点 p.A165(rs2642438)。研究者在多种携带 p.A165 等位基因的人源肝癌细胞系中,通过 siRNA 敲低和 CRISPR-Cas9 稳定敲除 MTARC1,系统评估其对肿瘤细胞增殖、迁移、脂质代谢和脂肪酸 β-氧化的影响,并在皮下异种移植小鼠模型中验证体内效应。结果显示,MTARC1 p.A165 的下调显著抑制肝癌细胞增殖与迁移,减少中性脂质在细胞内的积累,同时增强脂肪酸 β-氧化;在体内模型中,MTARC1 缺失显著降低肿瘤体积。蛋白质组学数据分析表明,无论在体外细胞还是体内肿瘤中,MTARC1 缺失均伴随促肿瘤信号通路的抑制和抗增殖蛋白的激活。总体而言,该研究揭示了 MTARC1 p.A165 在调控肝癌脂质代谢和肿瘤侵袭性中的关键作用,提示 MTARC1 可能成为肝细胞癌具有代谢基础的潜在治疗靶点。
原文链接:https://e-cmh.org/journal/view.php?doi=10.3350/cmh.2025.1261

7. (PROTEIN CELL,IF:13.6) 食管鳞状细胞癌多组学研究进展:从诊断、预后与治疗视角出发
2026年2月4日,郑州大学胸科医院等中国食管癌多组学研究团队在 Protein & Cell发表了题为 Advances in multi-omics for esophageal squamous cell carcinoma: Diagnostic, prognostic, and therapeutic perspectives的综述文章,系统总结了多组学技术在食管鳞状细胞癌(ESCC)诊断、预后和治疗策略开发中的最新进展。
这篇综述指出,尽管放疗、化疗和免疫治疗取得了一定进展,食管鳞状细胞癌因其显著的个体间及肿瘤内异质性仍预后不良,因此迫切需要基于分子层面的诊断和治疗策略。高通量组学技术——包括基因组学、转录组学、蛋白质组学和代谢组学——已极大推动了对 ESCC 生物学的理解:基因组分析揭示了如 TP53、NOTCH1 等反复改变及 PIK3CA、FGFR1、SOX2 等可施治扩增事件,表观基因组和转录组研究发现了基于甲基化的早期检测标志物和与免疫治疗反应及预后相关的转录型亚型,蛋白质组与代谢组分析则揭示了细胞周期、剪接体通路激活及乳酸代谢改变等新的生物标志物和治疗线索。尽管这些多组学发现为精准诊疗提供了理论基础,但临床转化仍面临分析流程标准化不足、多中心验证有限以及数据整合成本与复杂性高等挑战;未来整合人工智能与多组学数据的研究有望提高诊断精度并推动更精细的治疗决策。
原文链接: https://pubmed.ncbi.nlm.nih.gov/41639002/
声明:本文内容基于期刊公开信息整理,中文解读及科普文字由多个AI 助手生成,旨在帮助大众快速理解前沿研究,不构成任何专业建议或诊断依据。如需实验或临床应用,请以原始文献与专业人士意见为准。