继去年夏天全球首个低分辨临床蛋白质谱诊断产品获批后,新年伊始,欧米再传捷报,迎来国际化进程的关键里程碑。
2026年1月21日,西湖欧米在临床蛋白质谱体外诊断(IVD)领域迎来又一重要里程碑——公司自主研发的胰岛素样生长因子Ⅰ(IGF-Ⅰ)检测试剂盒(液相色谱-串联质谱法,LC-MS/MS),正式完成欧盟CE认证,并已收录于欧洲医疗器械数据库EUDAMED,获准进入欧盟市场。
这一进展,标志着中国原创的临床蛋白质谱诊断产品,在完成国内注册后,进一步通过了欧洲医疗器械法规体系的系统性审查,实现了从中国首创走向国际合规的关键跨越。
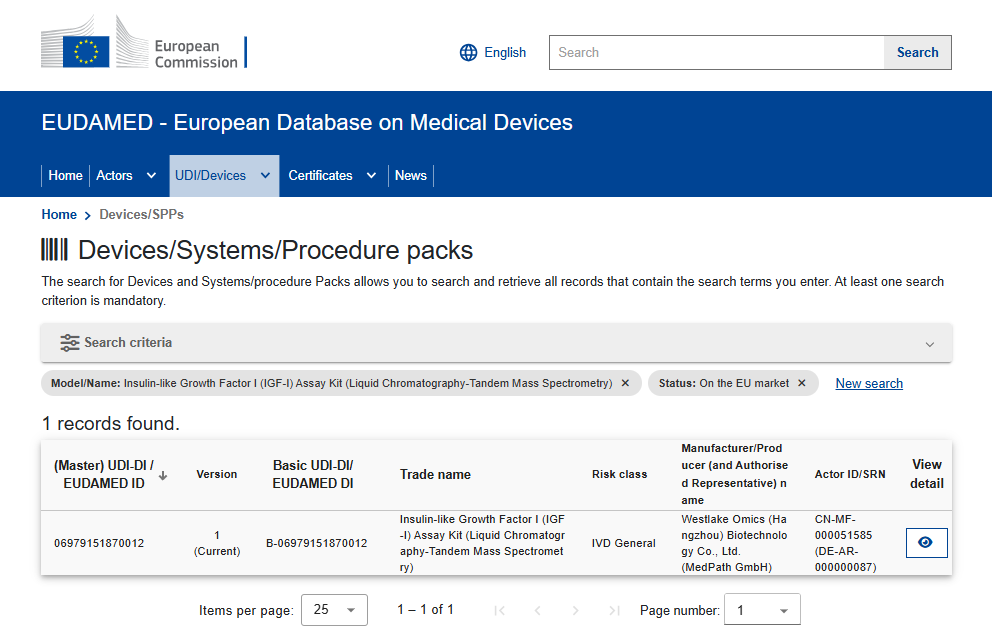
EUDAMED - 欧洲医疗器械数据库中公开查询界面
什么是欧盟 CE 认证?
CE认证是产品进入欧盟及欧洲贸易自由区市场的强制性认证标志。西湖欧米产品成功获得CE认证,这不仅是对其卓越性能与安全性的国际权威背书,更是公司在国际精准诊断舞台上的高光亮相,为中国智造的尖端IVD产品走向全球市场树立了典范。
这是中国大分子临床质谱精准诊断领域进展的一小步,是西湖欧米成长的一大步。
从源头创新到临床落地
时间回到2025年7月15日。首创!科技革新撬动精准诊断新场景——西湖欧米自主研发全球首个低分辨临床蛋白质谱诊断产品获批
西湖欧米自主研发的IGF-Ⅰ检测试剂盒,正式获得浙江省药品监督管理局颁发的二类体外诊断试剂注册证,成为全球首个获批的低分辨率临床蛋白质谱诊断产品。
这一成果,填补了国内临床蛋白质谱诊断产品的空白,也打破了高端蛋白质谱检测长期依赖进口的格局,为蛋白质组学技术在临床常规检测中的落地,提供了可复制、可推广的现实范式。
IGF-Ⅰ是评估生长发育、内分泌功能及相关疾病的重要生物标志物,其检测结果的准确性直接影响临床判断。与传统免疫检测方法相比,基于LC-MS/MS的检测方案,在特异性、抗干扰能力及定量准确性方面具备天然优势,但其临床化长期面临技术复杂、应用门槛高等挑战。
西湖欧米的突破,正是将这一前沿技术真正转化为临床可用、可规范推广的IVD产品。

图中产品仅为示意图
从中国应用到迈向世界
在IVD领域,CE认证并非简单的产品备案,而是对产品质量管理体系、风险控制、技术可靠性及临床性能证据的一整套系统性评估。长期以来,能够获得CE注册的IVD产品,通常被视为具备进入国际主流市场的基础门槛,也是全球医院、实验室和合作机构在产品遴选过程中普遍参考的重要标准。无论是罗氏(Roche)、西门子医疗(Siemens Healthineers)等国际企业的成熟产品,还是基于新兴精准诊断技术路线的创新方案,均需在同一监管与评价体系下完成CE 注册,方可进入欧洲市场并实现规范化应用。
此次西湖欧米IGF-Ⅰ检测试剂盒成功获得CE认证,并完成EUDAMED登记,意味着该产品在质量管理体系、技术文件完整性、风险控制、临床性能证据等方面,满足欧盟体外诊断医疗器械法规要求。
这不仅是一张进入欧洲市场的“通行证”,更代表着中国原创的临床蛋白质谱产品,在国际主流监管体系下获得了系统性认可。
我们期待,这一产品的广泛应用,能够为临床医生提供更可靠、更一致的检测依据,帮助实现对生长发育及内分泌相关疾病的更早识别与更精准评估,最终让更多患者受益于更加科学、精准的诊疗决策。

2025年10月,西湖欧米IGF-Ⅰ检测试剂盒荣获“中国蛋白质组学十大进展”殊荣
继去年夏天全球首个低分辨临床蛋白质谱诊断产品获批后,新年伊始,欧米再传捷报,迎来国际化进程的关键里程碑。
2026年1月21日,西湖欧米在临床蛋白质谱体外诊断(IVD)领域迎来又一重要里程碑——公司自主研发的胰岛素样生长因子Ⅰ(IGF-Ⅰ)检测试剂盒(液相色谱-串联质谱法,LC-MS/MS),正式完成欧盟CE认证,并已收录于欧洲医疗器械数据库EUDAMED,获准进入欧盟市场。
这一进展,标志着中国原创的临床蛋白质谱诊断产品,在完成国内注册后,进一步通过了欧洲医疗器械法规体系的系统性审查,实现了从中国首创走向国际合规的关键跨越。

EUDAMED - 欧洲医疗器械数据库中公开查询界面
什么是欧盟 CE 认证?
CE认证是产品进入欧盟及欧洲贸易自由区市场的强制性认证标志。西湖欧米产品成功获得CE认证,这不仅是对其卓越性能与安全性的国际权威背书,更是公司在国际精准诊断舞台上的高光亮相,为中国智造的尖端IVD产品走向全球市场树立了典范。
这是中国大分子临床质谱精准诊断领域进展的一小步,是西湖欧米成长的一大步。
从源头创新到临床落地
时间回到2025年7月15日。首创!科技革新撬动精准诊断新场景——西湖欧米自主研发全球首个低分辨临床蛋白质谱诊断产品获批
西湖欧米自主研发的IGF-Ⅰ检测试剂盒,正式获得浙江省药品监督管理局颁发的二类体外诊断试剂注册证,成为全球首个获批的低分辨率临床蛋白质谱诊断产品。
这一成果,填补了国内临床蛋白质谱诊断产品的空白,也打破了高端蛋白质谱检测长期依赖进口的格局,为蛋白质组学技术在临床常规检测中的落地,提供了可复制、可推广的现实范式。
IGF-Ⅰ是评估生长发育、内分泌功能及相关疾病的重要生物标志物,其检测结果的准确性直接影响临床判断。与传统免疫检测方法相比,基于LC-MS/MS的检测方案,在特异性、抗干扰能力及定量准确性方面具备天然优势,但其临床化长期面临技术复杂、应用门槛高等挑战。
西湖欧米的突破,正是将这一前沿技术真正转化为临床可用、可规范推广的IVD产品。

图中产品仅为示意图
从中国应用到迈向世界
在IVD领域,CE认证并非简单的产品备案,而是对产品质量管理体系、风险控制、技术可靠性及临床性能证据的一整套系统性评估。长期以来,能够获得CE注册的IVD产品,通常被视为具备进入国际主流市场的基础门槛,也是全球医院、实验室和合作机构在产品遴选过程中普遍参考的重要标准。无论是罗氏(Roche)、西门子医疗(Siemens Healthineers)等国际企业的成熟产品,还是基于新兴精准诊断技术路线的创新方案,均需在同一监管与评价体系下完成CE 注册,方可进入欧洲市场并实现规范化应用。
此次西湖欧米IGF-Ⅰ检测试剂盒成功获得CE认证,并完成EUDAMED登记,意味着该产品在质量管理体系、技术文件完整性、风险控制、临床性能证据等方面,满足欧盟体外诊断医疗器械法规要求。
这不仅是一张进入欧洲市场的“通行证”,更代表着中国原创的临床蛋白质谱产品,在国际主流监管体系下获得了系统性认可。
我们期待,这一产品的广泛应用,能够为临床医生提供更可靠、更一致的检测依据,帮助实现对生长发育及内分泌相关疾病的更早识别与更精准评估,最终让更多患者受益于更加科学、精准的诊疗决策。

2025年10月,西湖欧米IGF-Ⅰ检测试剂盒荣获“中国蛋白质组学十大进展”殊荣







