衰老是癌症和神经退行性疾病等多种疾病的重要风险因素。2013年提出的九大衰老标志在2023年扩展为十二项,凸显衰老过程的复杂性及研究潜力。多器官组学研究揭示不同器官间衰老的异步性与细胞类型特异特征,但现有蛋白质组学研究受限于器官覆盖和时间分辨率,尚未系统解析内分泌、视觉、肠道及生殖系统的衰老特征。PR被认为是延缓衰老的有效膳食干预,可改善代谢状态并调控IGF1、mTOR与FGF21信号通路。然而,其效应具有年龄与组织特异性,最优干预时机尚待明确。
2025年10月24日,西湖大学医学院郭天南实验室在Cell杂志发表了文章Protein restriction reprograms the multi-organ proteomic landscape of mouse aging,研究团队开展了覆盖41种小鼠组织的系统蛋白质组学研究,全面描绘雄性小鼠衰老及膳食蛋白质限制(PR)过程中的多器官分子变化。鉴定出组织特异性的衰老标志物,包括免疫球蛋白和丝氨酸蛋白酶抑制剂在多组织中的广泛变化。PR可缓解与年龄相关的蛋白表达、表观基因组及磷酸化模式改变,并显著改善脂肪组织功能。RRBS(一种DNA甲基化检测技术)、磷酸化蛋白组及病理学分析均验证了这些发现。进一步的小鼠与人血浆分析证实PR对心血管系统具有保护作用。研究揭示了PR效应的性别与时间依赖性,其中中年期为干预最佳窗口。整体上,本研究系统刻画了多器官衰老进程,并阐明了PR的抗衰潜力。

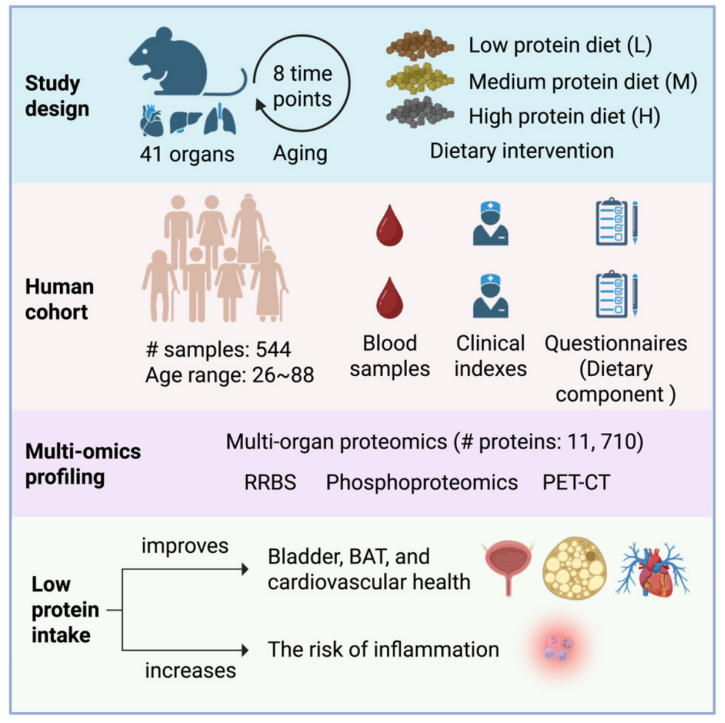
本研究系统采集了小鼠8个月龄时间点的41种器官,并在3个时期(7~10、12~15、20~23月龄)实施PR干预,结合小鼠与人血浆样本评估系统效应。基于DIA与TMT技术,构建了多器官高分辨率蛋白质组图谱,揭示衰老过程中组织特异性的分子特征及36种在衰老过程中普遍改变的蛋白质,PR可部分逆转这些改变,并调节与衰老相关的表观修饰与磷酸化模式。值得注意的是,中年期启动PR可在多器官中产生最显著的抗衰效应。总体而言,本研究填补了多器官衰老蛋白质组学空白,阐明PR的抗衰机制与最佳干预时机。
构建多器官衰老图谱,揭示PR的代谢获益
为了系统探索衰老与蛋白质摄入的关系,研究团队对小鼠41个器官在8个时间点(1至24月龄)进行了系统采样,并在另一组小鼠中设计了三种不同蛋白质比例(高蛋白40%、中蛋白20.7%、低蛋白5.0%)的为期三个月的饮食干预实验。
研究者建立了包含13,042种蛋白质的高质量小鼠谱图库,并在2565个组织样本中定量分析了超过11,000种蛋白质,绘制出覆盖全身的多器官蛋白质组图谱。分析显示,免疫、生殖和代谢器官在衰老过程中变化最为显著,其中不同部位的淋巴结呈现区域特异性衰老模式:腹股沟淋巴结变化最显著,而颌下淋巴结相对稳定。空间转录组学进一步验证了这种区域和细胞类型特异性。
在饮食干预中,代谢相关器官(肝脏、棕色脂肪、白色脂肪和胰腺)受影响最明显。低蛋白饮食组小鼠体重下降,同时改善了高蛋白饮食导致的脂肪组织异常,包括白色脂肪细胞肥大和棕色脂肪形态受损。此外,PR显著减少了老年及高蛋白饮食小鼠肾脏中衰老细胞的积累(SA-β-Gal染色),提示其具备抗衰潜力。然而,研究也注意到低蛋白饮食可能对肝脏产生轻微不良影响。
总体而言,这项研究不仅构建了首个覆盖全身41个器官的衰老与PR蛋白质组图谱,还揭示了低蛋白饮食在促进代谢健康与延缓衰老方面的潜在优势。
PR逆转Hsp90ab1和Ahsa1在多器官衰老过程的变化趋势
研究团队通过多器官蛋白质组分析,发现36个蛋白质在9个以上器官中持续改变,包括免疫球蛋白链(Igh-3、Igkc、Ighm)和丝氨酸蛋白酶抑制剂(Serpina1e、Serpinh1),且这些变化早在1月龄就已出现,提示衰老起始比预期更早。
进一步分析显示,在衰老过程中下调的22个蛋白质可被PR逆转,即在相应器官中上调。其中最明显的包括Hsp90ab1和Ahsa1,在多个脑区及其他器官中随衰老下调,它们均参与Hsp90伴侣蛋白调控,影响蛋白折叠和细胞稳态。
功能验证中,星形胶质细胞中敲除Hsp90ab1或Ahsa1均导致细胞增殖降低。值得注意的是,仅Hsp90ab1敲除细胞表现出衰老增加、凋亡升高及细胞周期紊乱。这些结果表明,PR或许能通过调控Hsp90ab1和Ahsa1发挥抗衰老作用。
PR通过调控DNA甲基化保护泌尿系统,减缓衰老并降低癌症风险
研究发现,DNA甲基化关键酶Dnmt3a在膀胱和肾脏中显著变化,Dnmt1在低蛋白饮食的雌性小鼠膀胱中上调,提示PR可能通过调节泌尿系统的DNA甲基化模式发挥作用。
对年轻(4月龄)与老年(24月龄)小鼠,以及高蛋白与低蛋白饮食雌性小鼠膀胱的DNA甲基化测序显示,整体甲基化水平保持稳定,同时差异甲基化区域通路分析揭示衰老和PR都影响了增殖及癌症相关通路。
进一步分析显示,衰老导致多种肿瘤抑制基因启动子高甲基化,高蛋白饮食亦有类似效应。其中,衰老与高蛋白饮食共有的13个癌症DNA甲基化生物标志物均呈高甲基化状态,提示二者都可能增加潜在的癌症风险。相反,低蛋白饮食可减少肾脏衰老、上调保护性基因Sesn2,并降低膀胱预测的生物学年龄,显示PR具有潜在的保护效应。
磷酸化蛋白质组学揭示衰老和PR对激酶的广泛调控
研究团队通过磷酸化蛋白质组学分析发现,PR广泛调节衰老相关激酶及其底物的磷酸化状态。作为寿命调控的重要能量代谢通路,AMPK的6个亚基在衰老过程中下调,而PR能够逆转这一变化,尤其在棕色脂肪组织和胰腺中最为显著。分析显示,PR显著上调了AMPK识别基序的磷酸化水平。例如,中年雄性低蛋白小鼠的棕色脂肪组织中,AMPK靶标糖原合成酶2(Gys2)磷酸化显著增加,提示能量更多用于消耗而非糖原合成。
在脑干,PR上调星形胶质细胞磷酸化蛋白PEA-15的AMPK基序磷酸化。在精囊中,衰老引起SVS4和SVS5的磷酸肽上调,而PR可下调这些磷酸肽,显示PR在生殖系统中潜在的保护作用。
此外,衰老期间最显著失调的激酶包括Map2k6、Prkd3和Prkaca;PR则调节非典型激酶,如Coq8a、Coq8b和Adck5。总体而言,此研究揭示了衰老和PR作用下激酶活性和蛋白磷酸化模式的显著改变。
PR通过AMPK磷酸化提升脂肪组织功能,改善脂质代谢与胰岛素敏感性
前文的研究提示,PR或可通过调控AMPK磷酸化影响脂肪组织功能。我们使用正电子发射断层扫描法扫描小鼠棕色脂肪活性,显示在低蛋白饮食的小鼠中,棕色脂肪活性增强。此外,我们发现PR显著上调棕色脂肪的产热标志物Ucp1,中年雄性低蛋白小鼠中增加约三倍,同时Cidec和Cidea也明显上调,进一步支持低蛋白饮食提高棕色脂肪活性。白色脂肪组织中Ucp1的上调则提示白色脂肪出现棕色化现象。
研究团队还观察到棕色脂肪组织中脂质代谢关键酶Fasn、Acacb和Mgll显著上调,同时胰岛素受体Insr和葡萄糖转运蛋白Slc2a4表达增加,提示葡萄糖摄取增强,产热能力提升。同时,研究人员展示了PR下产热增强和胰岛素调控改善的分子基础,揭示了其中可能涉及的部分关键机制。
不仅如此,PR在多个器官中影响脂质和糖代谢,不同酶在不同器官的影响范围各异。例如,老年雄鼠Acacb变化仅限于棕色脂肪、阴囊和甲状腺,而中年雄鼠扩展到肝脏、胰腺和肾上腺。Apoa1、Lcat、Fabp4和Pck1呈相似趋势。中年雄鼠对PR最为敏感,表现出最显著的进食量、体重及脂肪功能改善。同时,PR在雌鼠中可升高Apoa1,提示心血管保护潜力,并可能通过DNA甲基化影响泌尿系统。总体来看,PR的代谢调控效果受性别与年龄共同影响,中年雄鼠获益最为明显。
PR改善血浆信号与心血管健康,并揭示器官衰老循环标志物
研究团队通过TMTpro 16plex质谱分析42只小鼠血浆蛋白质组,鉴定1245个高质量蛋白质。PR下,瘦素受体Lepr升高而瘦素Lep下降,反映脂肪减少和食欲增加,与前文观察到的小鼠体重下降和食物摄入增加一致。Igf1信号通路显著富集,低蛋白饮食小鼠血浆中Igf1和Ghr水平降低;此外,Apoa4和Apoc3等蛋白也呈显著变化,提示PR对生殖和心血管健康的潜在益处。
血浆–器官配对分析筛选出28个高相关蛋白质,其中16个涉及细胞间通讯,包括细胞黏附分子(Postn、Bcam、Pecam1、Ncam1、Nrcam、Glycam1)和表面受体(Cspg4、Lifr、Pigr、Egfr)。血浆中Bcam和Cspg4水平与白色脂肪和大脑中的表达高度相关,且PR可逆转其衰老相关变化,提示它们可能作为抗衰老循环标志物和潜在靶点。
适度PR改善代谢与心血管健康,极低蛋白摄入可能引发炎症
为了验证小鼠研究在人类中的适用性,研究团队分析了272名26至88岁个体的544份配对血浆样本和问卷数据。结果显示,低蛋白饮食与胰岛素和血红蛋白(HbA1c)水平降低相关,谷丙转氨酶(GPT)水平也下降,提示代谢健康改善和肝功能损伤风险降低。在不同蛋白质摄入条件下,人血浆中IGF-1信号通路显著富集,IGF1和GHR水平较低,与小鼠血浆中观察到的情况相似。
此外,蛋白质摄入量与低密度脂蛋白胆固醇呈正相关,收缩压也随蛋白质摄入增加而升高,表明适度蛋白质限制可降低心血管风险。然而,最显著的差异表达蛋白PTX3的上调和SELENOP的下调提示炎症反应增加,暗示极端低蛋白摄入的潜在副作用。
研究进一步探索了在人类和小鼠血浆中表现出相似衰老趋势但在PR下被逆转的蛋白质,包括Notch1、Notch2、Ncam1、Nrcam和Pecam1。这些蛋白质与细胞黏附和通讯密切相关,可能也是PR延缓衰老的潜在靶点。
总体来看,人类和小鼠血浆数据揭示了相似的调控模式,适度蛋白质限制可改善代谢、降低IGF-1信号和心血管风险,而极端蛋白质缺乏可能带来炎症副作用。
研究团队构建了覆盖41种器官、多个时间点的小鼠多器官蛋白质组图谱,系统揭示了PR对衰老的全身性影响,为膳食干预延缓衰老提供了重要线索。研究发现,PR通过组织特异性的蛋白质重塑调控衰老,影响蛋白质表达、DNA甲基化及磷酸化等多层分子过程。其中,中年阶段被提示为最关键的干预窗口。另外,该研究不仅关注传统的肝脏、肌肉等器官,还发现腹股沟和腘窝淋巴结、胸腺、阴囊和晶状体等以往被忽视组织中的显著衰老相关变化,绘制出更全面、更系统的“多器官衰老图谱”。
进一步分析表明,PR能激活棕色脂肪功能,增强产热,或许能进一步改善胰岛素敏感性,肥胖、糖尿病和心血管健康。随着年龄增长,棕色脂肪逐渐减少,而PR能部分逆转这一过程,这或许正是其抗衰老的关键机制之一。跨物种比较显示,PR在人类和小鼠中均能改善代谢与心血管功能,但过度限制蛋白质摄入可能导致肝功能受损或诱发炎症反应,提示适度和平衡的重要性。总体来看,该研究绘制出跨物种、多组学、多器官的PR与衰老图谱,揭示了其延缓衰老的分子基础,并强调中年阶段的最佳干预时机,为未来膳食调控型抗衰老研究提供了坚实的科学依据。
原文链接:https://www.cell.com/cell/abstract/S0092-8674(25)01133-X
文章内容源于本文第一作者,文章由bioart公众号排版。
郭天南实验室将于近期开展Westlake AIVC webinar series。下周二,我们邀请到了本篇Cell文章的第一作者陆恬进行分享,欢迎大家加入!

衰老是癌症和神经退行性疾病等多种疾病的重要风险因素。2013年提出的九大衰老标志在2023年扩展为十二项,凸显衰老过程的复杂性及研究潜力。多器官组学研究揭示不同器官间衰老的异步性与细胞类型特异特征,但现有蛋白质组学研究受限于器官覆盖和时间分辨率,尚未系统解析内分泌、视觉、肠道及生殖系统的衰老特征。PR被认为是延缓衰老的有效膳食干预,可改善代谢状态并调控IGF1、mTOR与FGF21信号通路。然而,其效应具有年龄与组织特异性,最优干预时机尚待明确。
2025年10月24日,西湖大学医学院郭天南实验室在Cell杂志发表了文章Protein restriction reprograms the multi-organ proteomic landscape of mouse aging,研究团队开展了覆盖41种小鼠组织的系统蛋白质组学研究,全面描绘雄性小鼠衰老及膳食蛋白质限制(PR)过程中的多器官分子变化。鉴定出组织特异性的衰老标志物,包括免疫球蛋白和丝氨酸蛋白酶抑制剂在多组织中的广泛变化。PR可缓解与年龄相关的蛋白表达、表观基因组及磷酸化模式改变,并显著改善脂肪组织功能。RRBS(一种DNA甲基化检测技术)、磷酸化蛋白组及病理学分析均验证了这些发现。进一步的小鼠与人血浆分析证实PR对心血管系统具有保护作用。研究揭示了PR效应的性别与时间依赖性,其中中年期为干预最佳窗口。整体上,本研究系统刻画了多器官衰老进程,并阐明了PR的抗衰潜力。


本研究系统采集了小鼠8个月龄时间点的41种器官,并在3个时期(7~10、12~15、20~23月龄)实施PR干预,结合小鼠与人血浆样本评估系统效应。基于DIA与TMT技术,构建了多器官高分辨率蛋白质组图谱,揭示衰老过程中组织特异性的分子特征及36种在衰老过程中普遍改变的蛋白质,PR可部分逆转这些改变,并调节与衰老相关的表观修饰与磷酸化模式。值得注意的是,中年期启动PR可在多器官中产生最显著的抗衰效应。总体而言,本研究填补了多器官衰老蛋白质组学空白,阐明PR的抗衰机制与最佳干预时机。
构建多器官衰老图谱,揭示PR的代谢获益
为了系统探索衰老与蛋白质摄入的关系,研究团队对小鼠41个器官在8个时间点(1至24月龄)进行了系统采样,并在另一组小鼠中设计了三种不同蛋白质比例(高蛋白40%、中蛋白20.7%、低蛋白5.0%)的为期三个月的饮食干预实验。
研究者建立了包含13,042种蛋白质的高质量小鼠谱图库,并在2565个组织样本中定量分析了超过11,000种蛋白质,绘制出覆盖全身的多器官蛋白质组图谱。分析显示,免疫、生殖和代谢器官在衰老过程中变化最为显著,其中不同部位的淋巴结呈现区域特异性衰老模式:腹股沟淋巴结变化最显著,而颌下淋巴结相对稳定。空间转录组学进一步验证了这种区域和细胞类型特异性。
在饮食干预中,代谢相关器官(肝脏、棕色脂肪、白色脂肪和胰腺)受影响最明显。低蛋白饮食组小鼠体重下降,同时改善了高蛋白饮食导致的脂肪组织异常,包括白色脂肪细胞肥大和棕色脂肪形态受损。此外,PR显著减少了老年及高蛋白饮食小鼠肾脏中衰老细胞的积累(SA-β-Gal染色),提示其具备抗衰潜力。然而,研究也注意到低蛋白饮食可能对肝脏产生轻微不良影响。
总体而言,这项研究不仅构建了首个覆盖全身41个器官的衰老与PR蛋白质组图谱,还揭示了低蛋白饮食在促进代谢健康与延缓衰老方面的潜在优势。
PR逆转Hsp90ab1和Ahsa1在多器官衰老过程的变化趋势
研究团队通过多器官蛋白质组分析,发现36个蛋白质在9个以上器官中持续改变,包括免疫球蛋白链(Igh-3、Igkc、Ighm)和丝氨酸蛋白酶抑制剂(Serpina1e、Serpinh1),且这些变化早在1月龄就已出现,提示衰老起始比预期更早。
进一步分析显示,在衰老过程中下调的22个蛋白质可被PR逆转,即在相应器官中上调。其中最明显的包括Hsp90ab1和Ahsa1,在多个脑区及其他器官中随衰老下调,它们均参与Hsp90伴侣蛋白调控,影响蛋白折叠和细胞稳态。
功能验证中,星形胶质细胞中敲除Hsp90ab1或Ahsa1均导致细胞增殖降低。值得注意的是,仅Hsp90ab1敲除细胞表现出衰老增加、凋亡升高及细胞周期紊乱。这些结果表明,PR或许能通过调控Hsp90ab1和Ahsa1发挥抗衰老作用。
PR通过调控DNA甲基化保护泌尿系统,减缓衰老并降低癌症风险
研究发现,DNA甲基化关键酶Dnmt3a在膀胱和肾脏中显著变化,Dnmt1在低蛋白饮食的雌性小鼠膀胱中上调,提示PR可能通过调节泌尿系统的DNA甲基化模式发挥作用。
对年轻(4月龄)与老年(24月龄)小鼠,以及高蛋白与低蛋白饮食雌性小鼠膀胱的DNA甲基化测序显示,整体甲基化水平保持稳定,同时差异甲基化区域通路分析揭示衰老和PR都影响了增殖及癌症相关通路。
进一步分析显示,衰老导致多种肿瘤抑制基因启动子高甲基化,高蛋白饮食亦有类似效应。其中,衰老与高蛋白饮食共有的13个癌症DNA甲基化生物标志物均呈高甲基化状态,提示二者都可能增加潜在的癌症风险。相反,低蛋白饮食可减少肾脏衰老、上调保护性基因Sesn2,并降低膀胱预测的生物学年龄,显示PR具有潜在的保护效应。
磷酸化蛋白质组学揭示衰老和PR对激酶的广泛调控
研究团队通过磷酸化蛋白质组学分析发现,PR广泛调节衰老相关激酶及其底物的磷酸化状态。作为寿命调控的重要能量代谢通路,AMPK的6个亚基在衰老过程中下调,而PR能够逆转这一变化,尤其在棕色脂肪组织和胰腺中最为显著。分析显示,PR显著上调了AMPK识别基序的磷酸化水平。例如,中年雄性低蛋白小鼠的棕色脂肪组织中,AMPK靶标糖原合成酶2(Gys2)磷酸化显著增加,提示能量更多用于消耗而非糖原合成。
在脑干,PR上调星形胶质细胞磷酸化蛋白PEA-15的AMPK基序磷酸化。在精囊中,衰老引起SVS4和SVS5的磷酸肽上调,而PR可下调这些磷酸肽,显示PR在生殖系统中潜在的保护作用。
此外,衰老期间最显著失调的激酶包括Map2k6、Prkd3和Prkaca;PR则调节非典型激酶,如Coq8a、Coq8b和Adck5。总体而言,此研究揭示了衰老和PR作用下激酶活性和蛋白磷酸化模式的显著改变。
PR通过AMPK磷酸化提升脂肪组织功能,改善脂质代谢与胰岛素敏感性
前文的研究提示,PR或可通过调控AMPK磷酸化影响脂肪组织功能。我们使用正电子发射断层扫描法扫描小鼠棕色脂肪活性,显示在低蛋白饮食的小鼠中,棕色脂肪活性增强。此外,我们发现PR显著上调棕色脂肪的产热标志物Ucp1,中年雄性低蛋白小鼠中增加约三倍,同时Cidec和Cidea也明显上调,进一步支持低蛋白饮食提高棕色脂肪活性。白色脂肪组织中Ucp1的上调则提示白色脂肪出现棕色化现象。
研究团队还观察到棕色脂肪组织中脂质代谢关键酶Fasn、Acacb和Mgll显著上调,同时胰岛素受体Insr和葡萄糖转运蛋白Slc2a4表达增加,提示葡萄糖摄取增强,产热能力提升。同时,研究人员展示了PR下产热增强和胰岛素调控改善的分子基础,揭示了其中可能涉及的部分关键机制。
不仅如此,PR在多个器官中影响脂质和糖代谢,不同酶在不同器官的影响范围各异。例如,老年雄鼠Acacb变化仅限于棕色脂肪、阴囊和甲状腺,而中年雄鼠扩展到肝脏、胰腺和肾上腺。Apoa1、Lcat、Fabp4和Pck1呈相似趋势。中年雄鼠对PR最为敏感,表现出最显著的进食量、体重及脂肪功能改善。同时,PR在雌鼠中可升高Apoa1,提示心血管保护潜力,并可能通过DNA甲基化影响泌尿系统。总体来看,PR的代谢调控效果受性别与年龄共同影响,中年雄鼠获益最为明显。
PR改善血浆信号与心血管健康,并揭示器官衰老循环标志物
研究团队通过TMTpro 16plex质谱分析42只小鼠血浆蛋白质组,鉴定1245个高质量蛋白质。PR下,瘦素受体Lepr升高而瘦素Lep下降,反映脂肪减少和食欲增加,与前文观察到的小鼠体重下降和食物摄入增加一致。Igf1信号通路显著富集,低蛋白饮食小鼠血浆中Igf1和Ghr水平降低;此外,Apoa4和Apoc3等蛋白也呈显著变化,提示PR对生殖和心血管健康的潜在益处。
血浆–器官配对分析筛选出28个高相关蛋白质,其中16个涉及细胞间通讯,包括细胞黏附分子(Postn、Bcam、Pecam1、Ncam1、Nrcam、Glycam1)和表面受体(Cspg4、Lifr、Pigr、Egfr)。血浆中Bcam和Cspg4水平与白色脂肪和大脑中的表达高度相关,且PR可逆转其衰老相关变化,提示它们可能作为抗衰老循环标志物和潜在靶点。
适度PR改善代谢与心血管健康,极低蛋白摄入可能引发炎症
为了验证小鼠研究在人类中的适用性,研究团队分析了272名26至88岁个体的544份配对血浆样本和问卷数据。结果显示,低蛋白饮食与胰岛素和血红蛋白(HbA1c)水平降低相关,谷丙转氨酶(GPT)水平也下降,提示代谢健康改善和肝功能损伤风险降低。在不同蛋白质摄入条件下,人血浆中IGF-1信号通路显著富集,IGF1和GHR水平较低,与小鼠血浆中观察到的情况相似。
此外,蛋白质摄入量与低密度脂蛋白胆固醇呈正相关,收缩压也随蛋白质摄入增加而升高,表明适度蛋白质限制可降低心血管风险。然而,最显著的差异表达蛋白PTX3的上调和SELENOP的下调提示炎症反应增加,暗示极端低蛋白摄入的潜在副作用。
研究进一步探索了在人类和小鼠血浆中表现出相似衰老趋势但在PR下被逆转的蛋白质,包括Notch1、Notch2、Ncam1、Nrcam和Pecam1。这些蛋白质与细胞黏附和通讯密切相关,可能也是PR延缓衰老的潜在靶点。
总体来看,人类和小鼠血浆数据揭示了相似的调控模式,适度蛋白质限制可改善代谢、降低IGF-1信号和心血管风险,而极端蛋白质缺乏可能带来炎症副作用。
研究团队构建了覆盖41种器官、多个时间点的小鼠多器官蛋白质组图谱,系统揭示了PR对衰老的全身性影响,为膳食干预延缓衰老提供了重要线索。研究发现,PR通过组织特异性的蛋白质重塑调控衰老,影响蛋白质表达、DNA甲基化及磷酸化等多层分子过程。其中,中年阶段被提示为最关键的干预窗口。另外,该研究不仅关注传统的肝脏、肌肉等器官,还发现腹股沟和腘窝淋巴结、胸腺、阴囊和晶状体等以往被忽视组织中的显著衰老相关变化,绘制出更全面、更系统的“多器官衰老图谱”。
进一步分析表明,PR能激活棕色脂肪功能,增强产热,或许能进一步改善胰岛素敏感性,肥胖、糖尿病和心血管健康。随着年龄增长,棕色脂肪逐渐减少,而PR能部分逆转这一过程,这或许正是其抗衰老的关键机制之一。跨物种比较显示,PR在人类和小鼠中均能改善代谢与心血管功能,但过度限制蛋白质摄入可能导致肝功能受损或诱发炎症反应,提示适度和平衡的重要性。总体来看,该研究绘制出跨物种、多组学、多器官的PR与衰老图谱,揭示了其延缓衰老的分子基础,并强调中年阶段的最佳干预时机,为未来膳食调控型抗衰老研究提供了坚实的科学依据。
原文链接:https://www.cell.com/cell/abstract/S0092-8674(25)01133-X
文章内容源于本文第一作者,文章由bioart公众号排版。
郭天南实验室将于近期开展Westlake AIVC webinar series。下周二,我们邀请到了本篇Cell文章的第一作者陆恬进行分享,欢迎大家加入!









