多组学深度解码:
多胺通过调控蛋白质稳态维系衰老肠道再生,饮食干预或多胺补充成有效干预新策略

文章标题
研究内容
从损伤到修复:年轻小鼠的“基线轨迹”
为明确年轻与老年小鼠在肠道损伤后的再生修复差异,研究采用腹腔注射5-FU(150mg/kg)构建肠道损伤模型,对照组注射 PBS,分别在损伤后 2 天、5 天、7 天收集小肠组织进行多维度分析(Figure 1a);结果显示,年轻小鼠损伤后 2 天体重降至最低点(约下降 5%),5 天即可恢复至注射前水平(Figure 1b),同时肠道组织形态呈现明显修复轨迹——隐窝数量、绒毛细胞密度及增殖标志物 pH3 阳性细胞比例均在 2 天显著降低,5–7 天逐步回升(Figure 1c-f);通过 DIA-MS 定量 5,627 种蛋白并聚类,研究团队发现2,204 种受 5-FU 影响的蛋白可归为4 个功能簇,富集于转录翻译、脂质代谢、免疫应答与细胞外基质组织等与再生相关的通路(Figure 1g-h),其中核糖体与 MCM 复合物的表达趋势与细胞增殖/蛋白合成节奏高度一致(Figure 1i);外源嘌呤霉素掺入实验进一步验证,隐窝的蛋白质合成在 2 天显著降低,5–7 天恢复(Figure 1j-k)。
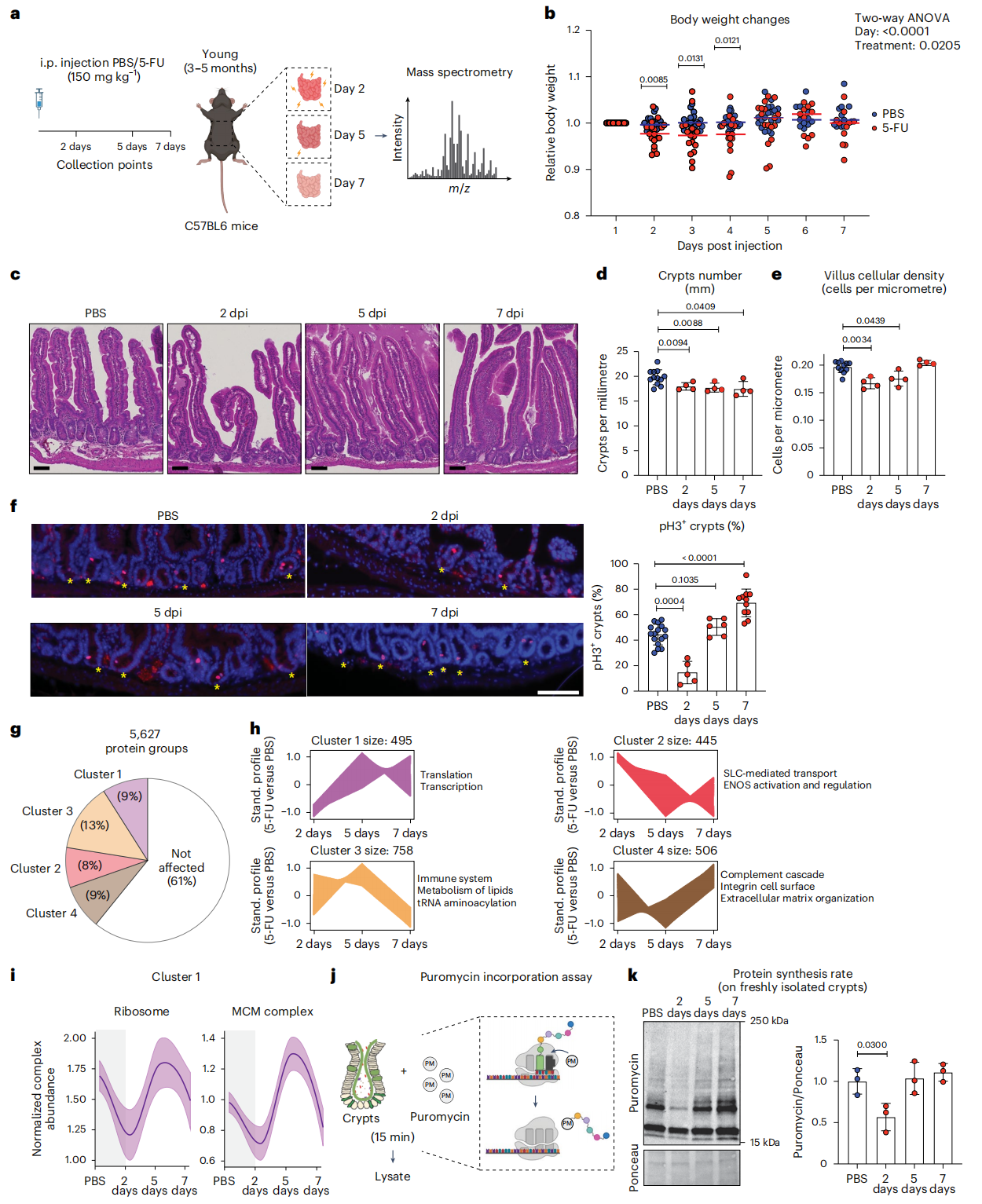
Figure 1 Identifying proteome dynamics during regeneration of young small intestines.
老年肠道再生为何“慢半拍”:蛋白稳态压力成为关键掣肘
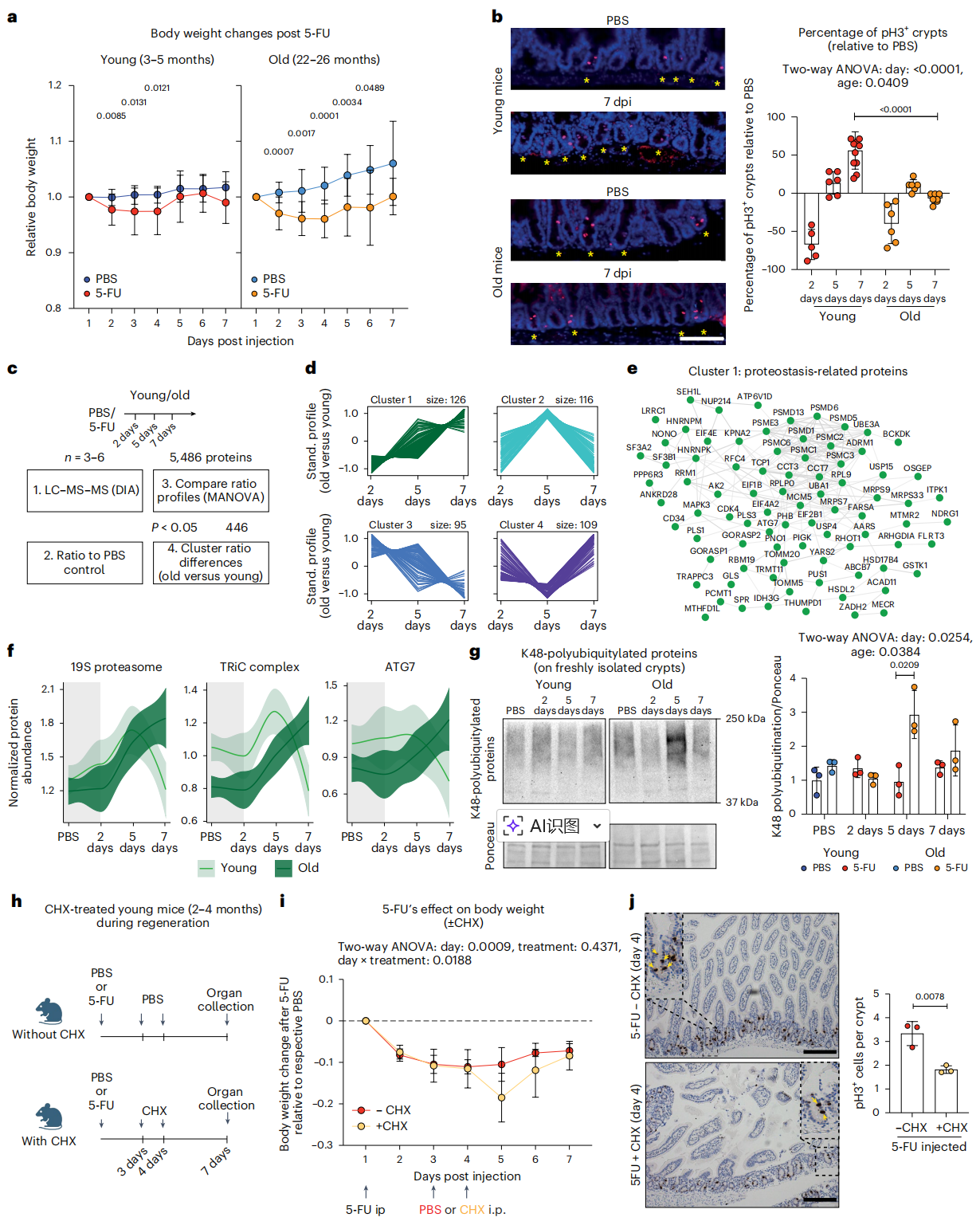
Figure 2 Proteostasis stress delays intestinal regeneration following 5-FU.
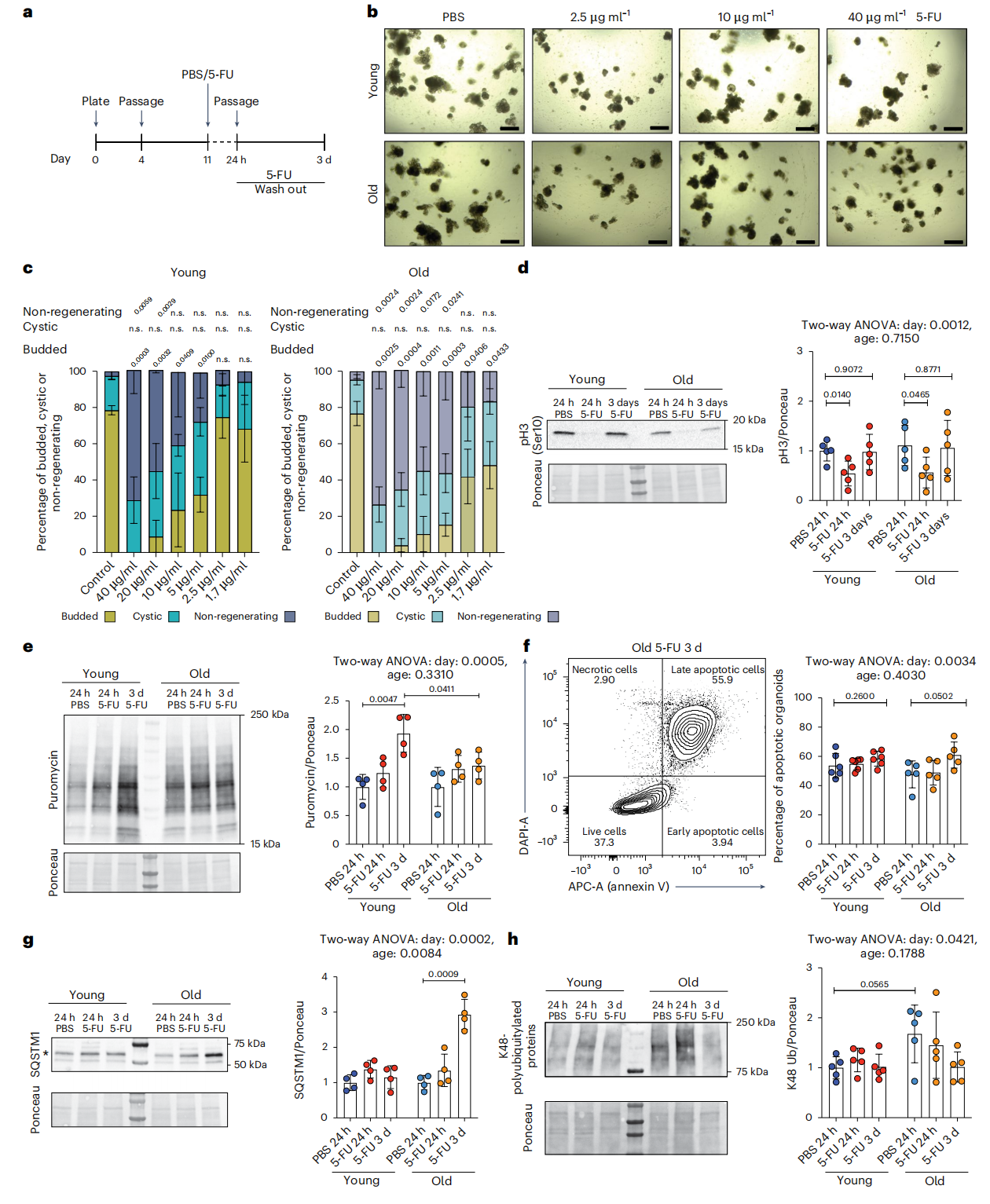
Figure 3 Delayed regeneration of organoids from old mice upon 5-FU treatment.
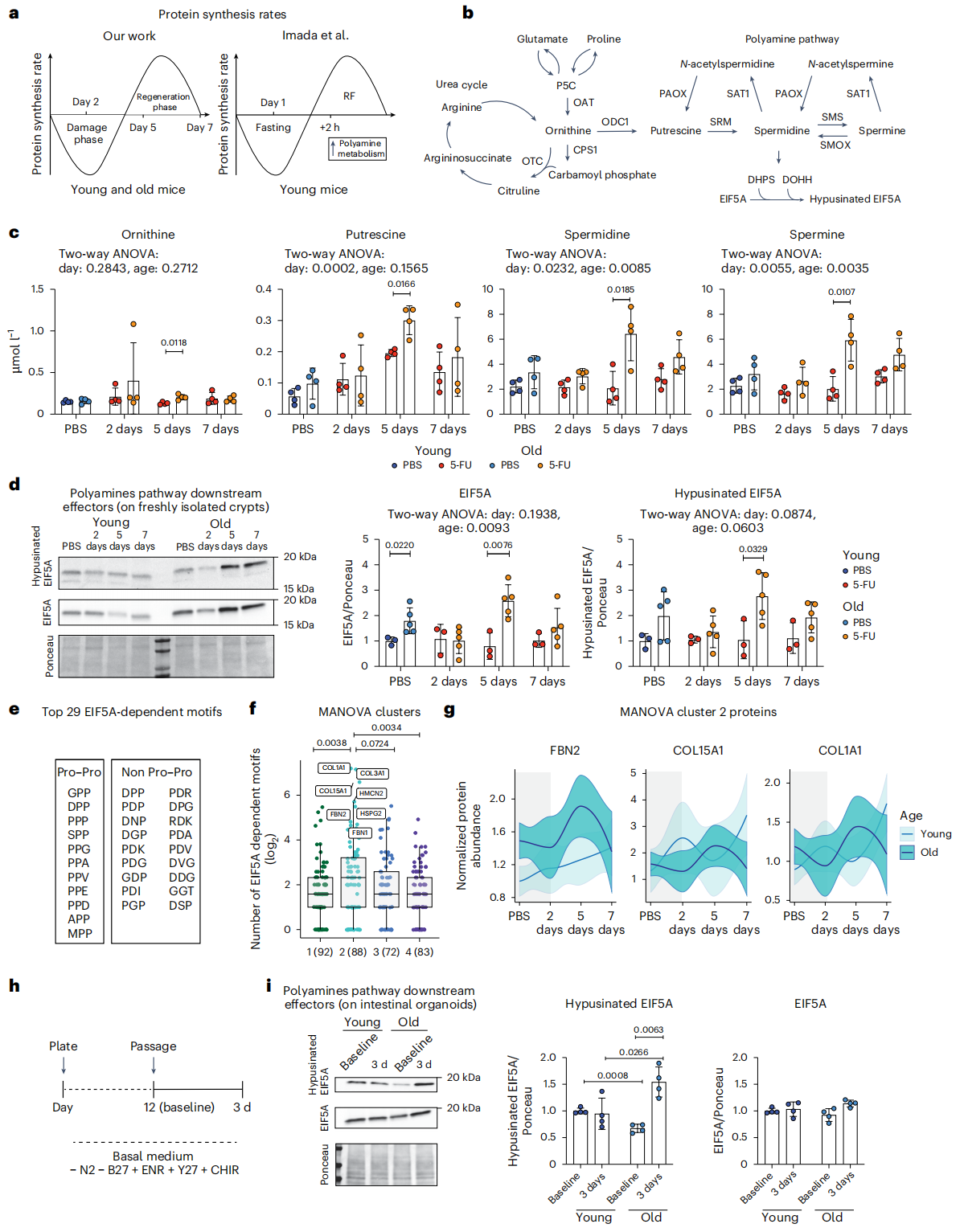
Figure 4 Polyamine pathway elevation upon 5-FU in the aged intestinal epithelium.
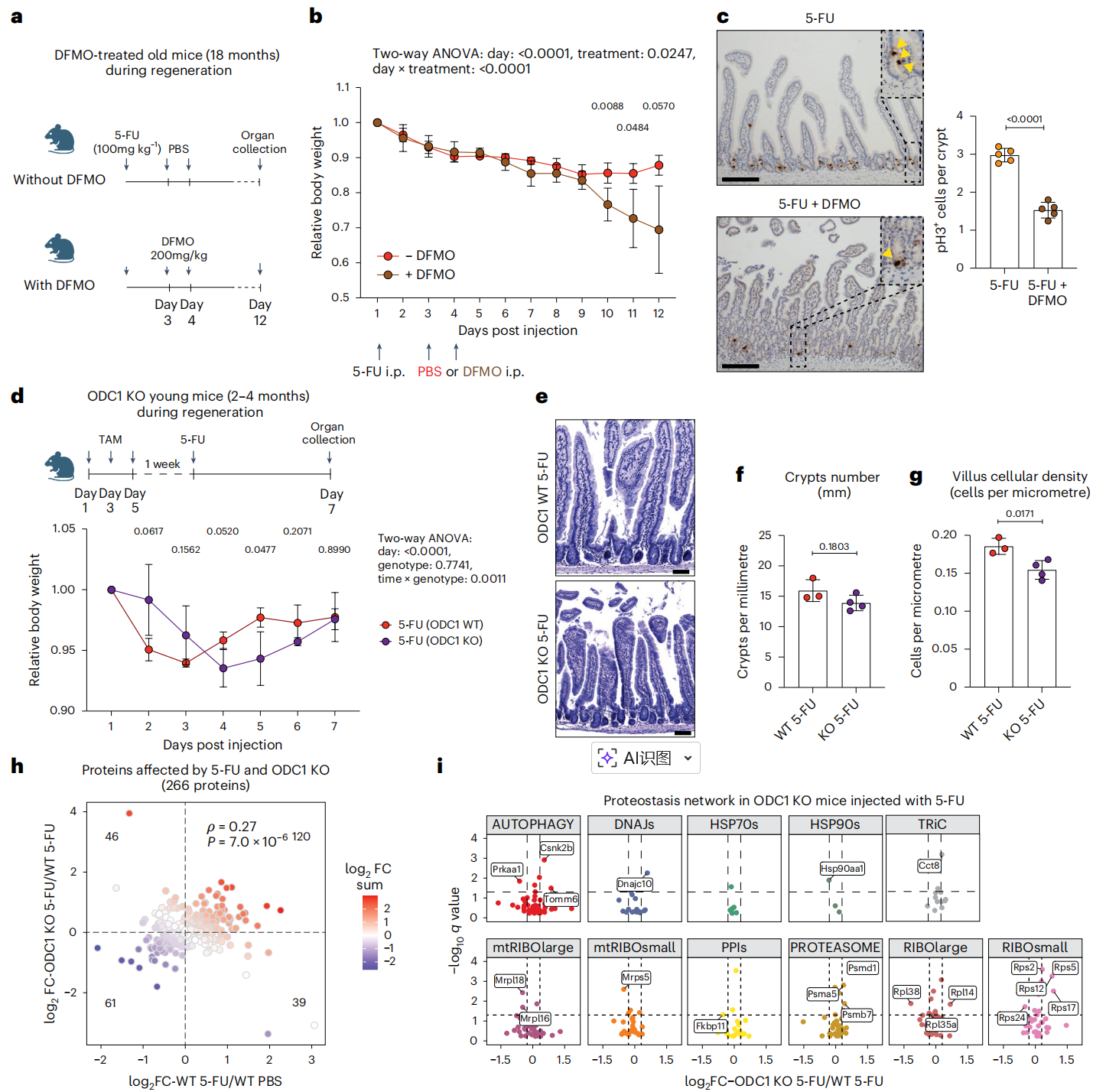
Figure 5 Polyamine pathway deficiency impairs intestinal regeneration in young and old mice.
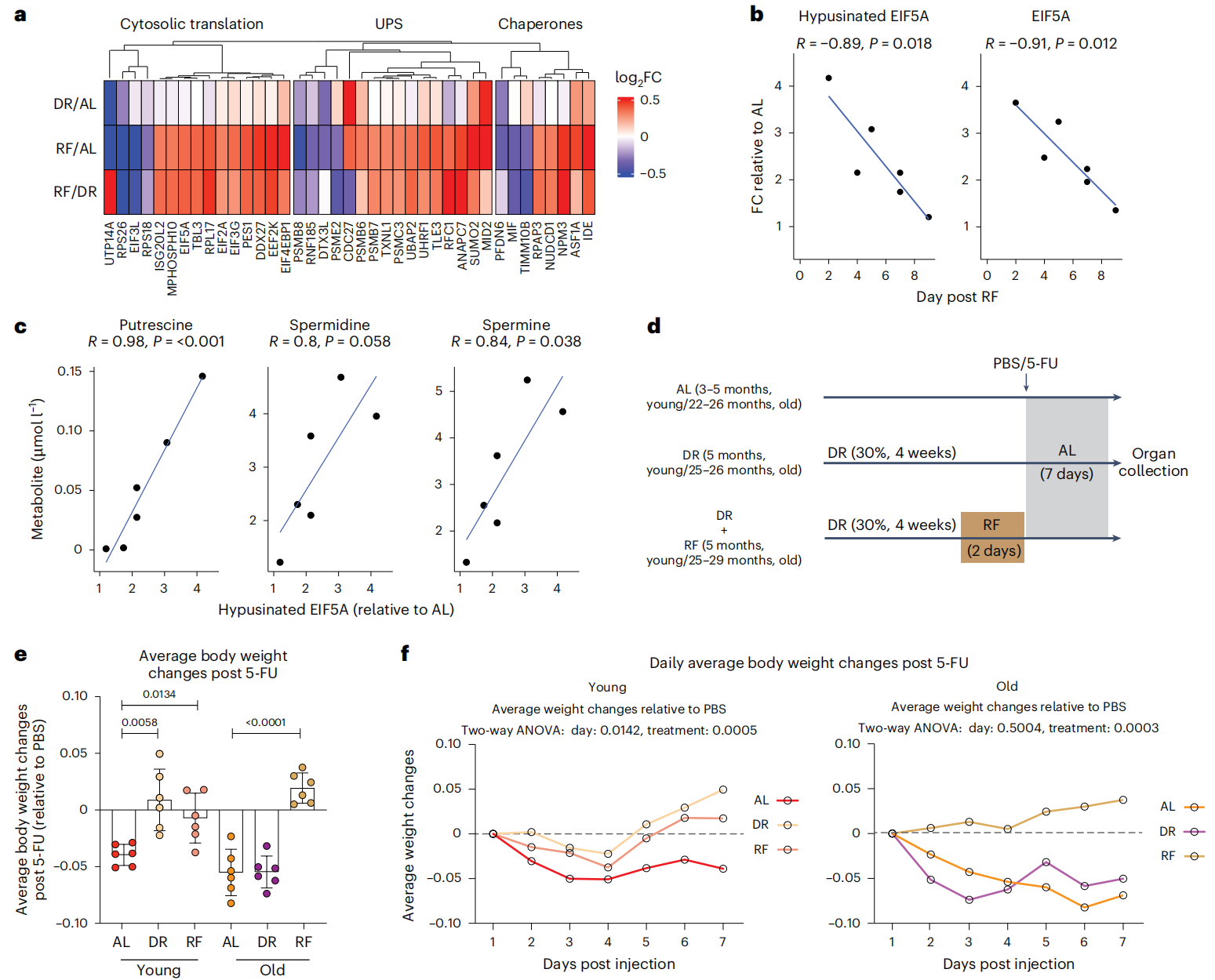
Figure 6 Effect of DR followed by RF on intestinal epithelium regeneration.
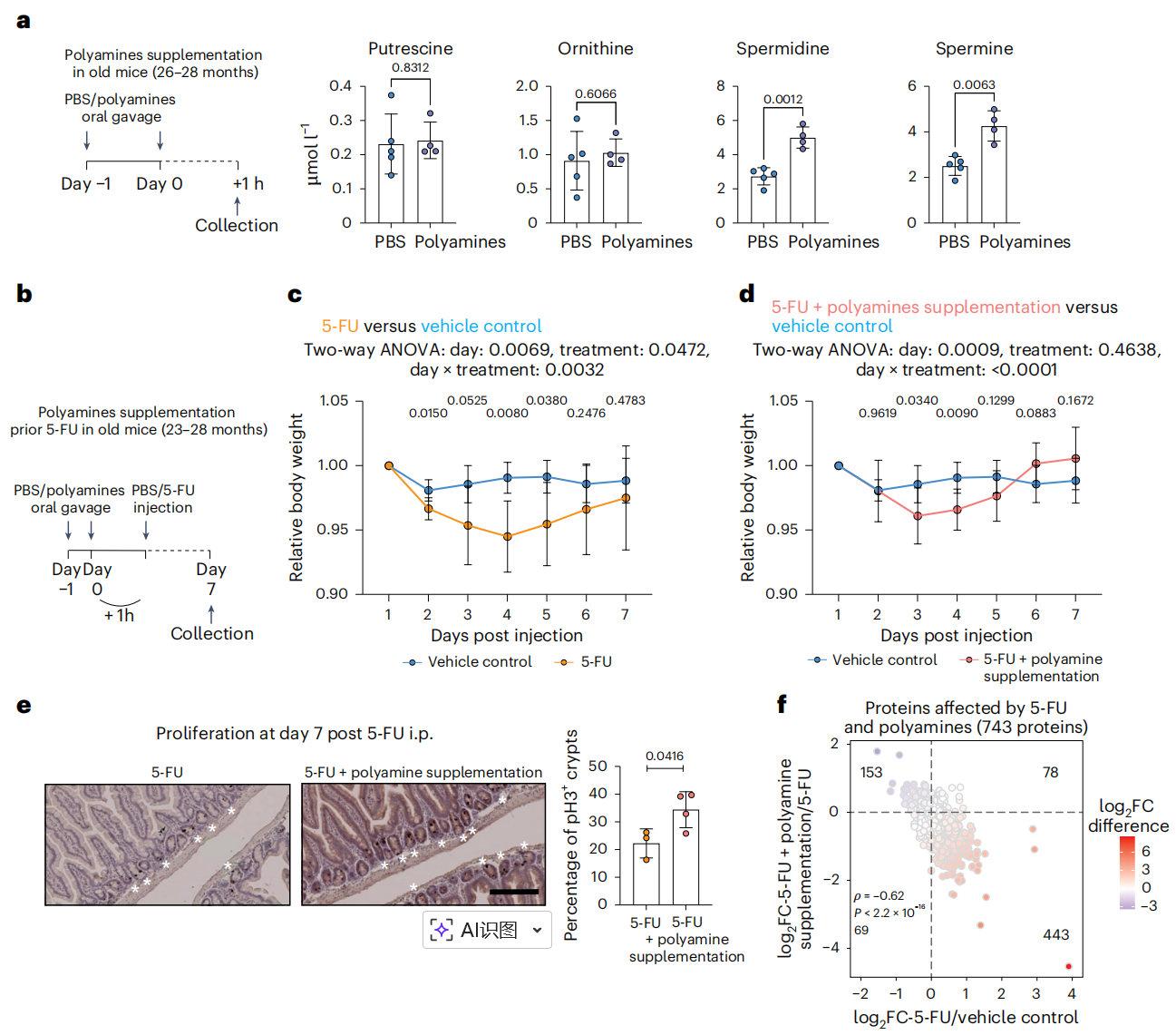
Figure 7 Effect of polyamine supplementation on intestinal epithelium regeneration in old mice.
总结与展望
这项工作以时间分辨蛋白质组+靶向代谢组为主轴,辅以类器官与在体干预的功能学闭环,首次把“老年肠道修复变慢”的分子瓶颈精准指向“蛋白质稳态压力”,并把“多胺-EIF5A-翻译”确立为关键的代偿与干预通路。对临床与大众而言,围绕化疗相关肠黏膜毒性的营养-代谢支持或将迎来更具机制依据的策略,例如合理设计的限食-再进食程序或个体化的多胺补充。但作者也提醒,考虑到多胺与肿瘤发生进程的阶段性关系,任何推广到人群的应用都需在风险-收益框架下严格评估、精准分层与规范随访。
原文链接:https://www.nature.com/articles/s41556-025-01804-9
多组学深度解码:
多胺通过调控蛋白质稳态维系衰老肠道再生,饮食干预或多胺补充成有效干预新策略

文章标题
研究内容
从损伤到修复:年轻小鼠的“基线轨迹”
为明确年轻与老年小鼠在肠道损伤后的再生修复差异,研究采用腹腔注射5-FU(150mg/kg)构建肠道损伤模型,对照组注射 PBS,分别在损伤后 2 天、5 天、7 天收集小肠组织进行多维度分析(Figure 1a);结果显示,年轻小鼠损伤后 2 天体重降至最低点(约下降 5%),5 天即可恢复至注射前水平(Figure 1b),同时肠道组织形态呈现明显修复轨迹——隐窝数量、绒毛细胞密度及增殖标志物 pH3 阳性细胞比例均在 2 天显著降低,5–7 天逐步回升(Figure 1c-f);通过 DIA-MS 定量 5,627 种蛋白并聚类,研究团队发现2,204 种受 5-FU 影响的蛋白可归为4 个功能簇,富集于转录翻译、脂质代谢、免疫应答与细胞外基质组织等与再生相关的通路(Figure 1g-h),其中核糖体与 MCM 复合物的表达趋势与细胞增殖/蛋白合成节奏高度一致(Figure 1i);外源嘌呤霉素掺入实验进一步验证,隐窝的蛋白质合成在 2 天显著降低,5–7 天恢复(Figure 1j-k)。

Figure 1 Identifying proteome dynamics during regeneration of young small intestines.
老年肠道再生为何“慢半拍”:蛋白稳态压力成为关键掣肘

Figure 2 Proteostasis stress delays intestinal regeneration following 5-FU.

Figure 3 Delayed regeneration of organoids from old mice upon 5-FU treatment.

Figure 4 Polyamine pathway elevation upon 5-FU in the aged intestinal epithelium.

Figure 5 Polyamine pathway deficiency impairs intestinal regeneration in young and old mice.

Figure 6 Effect of DR followed by RF on intestinal epithelium regeneration.

Figure 7 Effect of polyamine supplementation on intestinal epithelium regeneration in old mice.
总结与展望
这项工作以时间分辨蛋白质组+靶向代谢组为主轴,辅以类器官与在体干预的功能学闭环,首次把“老年肠道修复变慢”的分子瓶颈精准指向“蛋白质稳态压力”,并把“多胺-EIF5A-翻译”确立为关键的代偿与干预通路。对临床与大众而言,围绕化疗相关肠黏膜毒性的营养-代谢支持或将迎来更具机制依据的策略,例如合理设计的限食-再进食程序或个体化的多胺补充。但作者也提醒,考虑到多胺与肿瘤发生进程的阶段性关系,任何推广到人群的应用都需在风险-收益框架下严格评估、精准分层与规范随访。
原文链接:https://www.nature.com/articles/s41556-025-01804-9