01 (Nature) iPEX技术通过组织扩展实现微米分辨率的深度空间蛋白质组学
02 (Nature) 猪到人尸体肾异种移植的多组学分析
03 (NAT NEUROSCI) 雌激素调节奖励预测误差和强化学习
04 (NAT COMMUN) GroEL/ES分子伴侣展开并在核糖体上封装新生蛋白质
05 (NAT COMMUN) 表面蛋白表达的变化导致锥虫在宿主细胞感染过程中形成异质群体
06 (NAT COMMUN) Koina:使机器学习普及化用于蛋白质组学研究
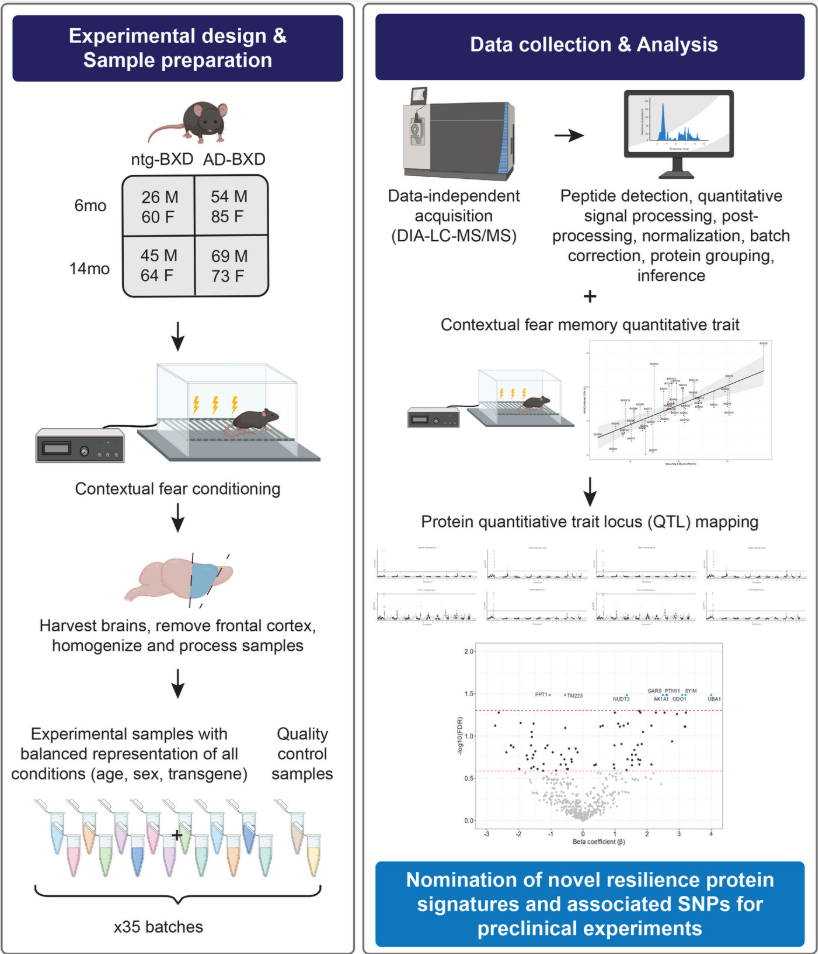
07 (ALZHEIMERS DEMENT) Nr1d1转录因子结合位点的遗传变异塑造了与阿尔茨海默病小鼠参考面板中认知弹性相关的代谢相关蛋白网络
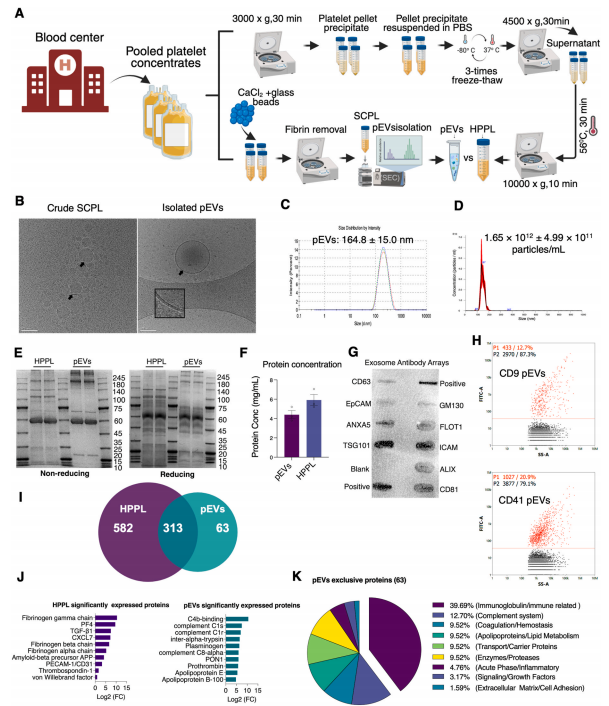
08 (INT J SURGS) 血小板浓缩物衍生的细胞外囊泡促进成年海马神经发生
一起来看看本期的蛋白质组学精选优质文献吧!

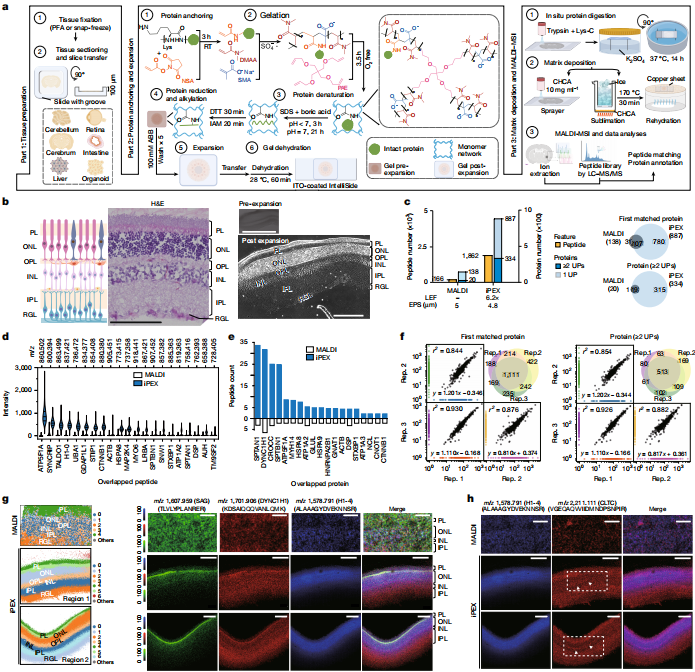
1. (Nature,IF:50.5) iPEX技术通过组织扩展实现微米分辨率的深度空间蛋白质组学
想象一下,如果我们能像在地图上找位置一样,精确知道每种蛋白质在组织中的分布,那将多么有助于疾病研究和诊断。近日,西湖大学邹贻龙团队与Kiryl D. Piatkevich团队在《Nature》杂志上发表了一项名为iPEX的新技术,让这一愿景成为现实。
iPEX的全称是“通过组织扩展实现微米分辨率的深度空间蛋白质组学”。它的核心原理是将组织样本用一种特殊的水凝胶处理,使其均匀膨胀,就像泡发银耳一样变大,再用质谱成像技术对膨胀后的组织进行分析。这种方法不仅提高了空间分辨率,还大幅提升了蛋白质检测的灵敏度。
在实验中,研究人员以小鼠视网膜为模型,成功绘制出高分辨率的蛋白质分布图,甚至可以区分单个细胞层和微小的突触结构。这项技术还适用于大脑、肝脏、肠道等多种组织,以及人类脑类器官,能同时检测600到1500种蛋白质。
更令人振奋的是,iPEX技术在阿尔茨海默病研究中展现出巨大潜力。科学家发现,在患病小鼠的大脑中,一种名为ACAA1A的蛋白质在疾病早期就显著减少。这种蛋白质参与维持大脑中重要脂肪酸的平衡,其缺失可能导致神经细胞膜功能异常,从而促进疾病发展。
iPEX不仅突破了传统蛋白质检测的分辨率和灵敏度限制,还为研究复杂组织结构中的蛋白质功能提供了强大工具。未来,这项技术有望推动精准医学的发展,帮助科学家更早发现疾病、理解疾病机制,并开发更有效的治疗方法。
原文链接: https://www.nature.com/articles/s41586-025-09734-0

2. (Nature,IF:50.5) 猪到人尸体肾异种移植的多组学分析

3. (Nature Neuroscience,IF:21.2) 雌激素调节奖励预测误差和强化学习
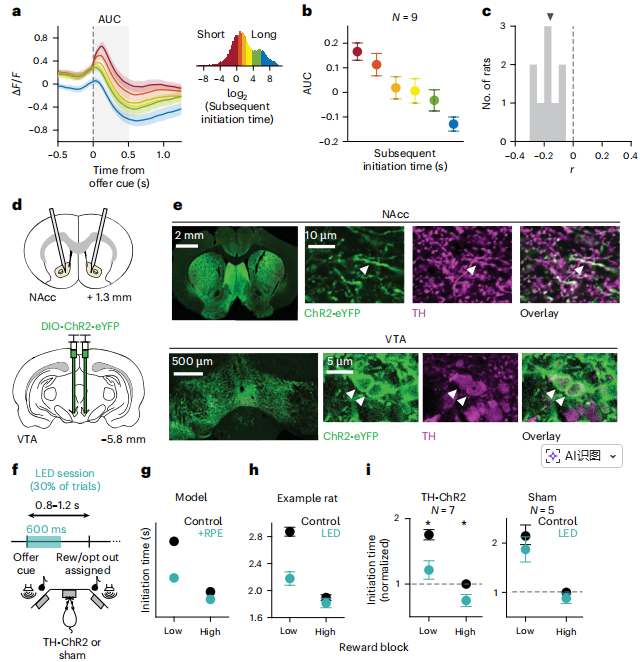

4.(Nature Communications,IF:14.7) GroEL/ES分子伴侣展开并在核糖体上封装新生蛋白质
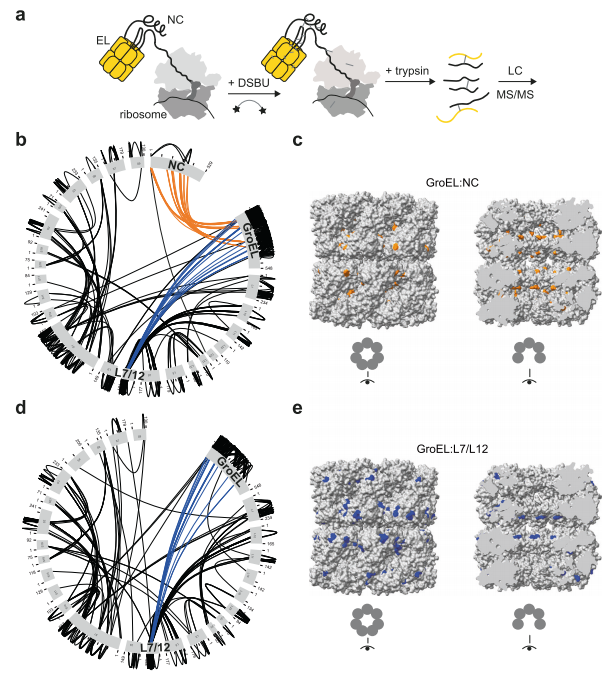

5. (Nature Communications,IF:14.7) 表面蛋白表达的变化导致锥虫在宿主细胞感染过程中形成异质群体
麦吉尔大学寄生虫学研究所团队发布克氏锥虫Sylvio X10株端粒到端粒完整基因组,31条染色体含2934个多基因家族(MGF)成员,占基因总数21%。TMT定量蛋白组显示转唾液酸酶(TS)、黏蛋白、MASP等毒力因子在感染型锥鞭毛体(CT)显著上调,且表达位点分散于各染色体。
作者设计MGF-seq追踪CT连续感染心肌细胞四代,发现82%的MGF转录本丰度动态变化,单群体可表达1300余种MGF,提示每轮感染均快速生成表面蛋白异质群体。酵母表面展示并用慢性Chagas患者血清筛选,约150种MGF被抗体识别,TS优势但N端序列保守度低,交叉反应有限。功能实验显示第一代CT侵袭率最高,随MGF多样性增加侵袭效率呈细胞类型依赖波动,而每代CT产量递增,表明表面抗原重编既助力免疫逃逸也优化宿主适应。
该研究阐明MGF基因组结构与表达噪声共同驱动克氏锥虫群体异质性,为疫苗和诊断靶点选择提供高分辨率图谱。

6. (Nature Communications,IF:14.7) Koina:使机器学习普及化用于蛋白质组学研究
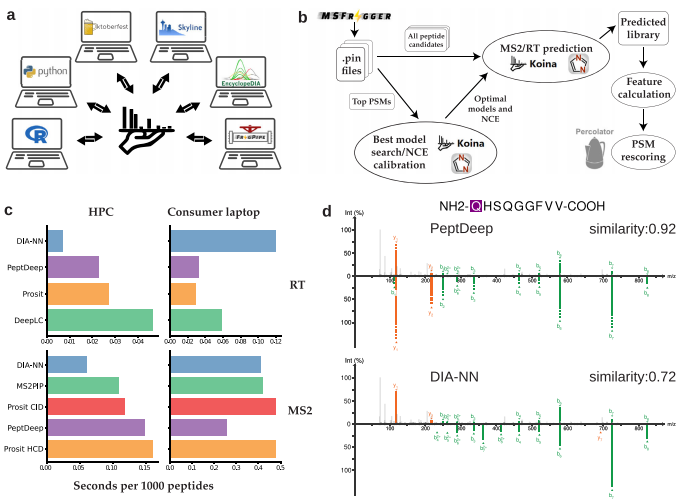

7. (Alzheimer's & Dementia,IF:13.0)Nr1d1转录因子结合位点的遗传变异塑造了与阿尔茨海默病小鼠参考面板中认知弹性相关的代谢相关蛋白网络

8. (Biomaterials,IF:12.8) 血小板浓缩物衍生的细胞外囊泡促进成年海马神经发生
声明:本文内容基于期刊公开信息整理,中文解读及科普文字由多个AI 助手生成,旨在帮助大众快速理解前沿研究,不构成任何专业建议或诊断依据。如需实验或临床应用,请以原始文献与专业人士意见为准。
01 (Nature) iPEX技术通过组织扩展实现微米分辨率的深度空间蛋白质组学
02 (Nature) 猪到人尸体肾异种移植的多组学分析
03 (NAT NEUROSCI) 雌激素调节奖励预测误差和强化学习
04 (NAT COMMUN) GroEL/ES分子伴侣展开并在核糖体上封装新生蛋白质
05 (NAT COMMUN) 表面蛋白表达的变化导致锥虫在宿主细胞感染过程中形成异质群体
06 (NAT COMMUN) Koina:使机器学习普及化用于蛋白质组学研究
07 (ALZHEIMERS DEMENT) Nr1d1转录因子结合位点的遗传变异塑造了与阿尔茨海默病小鼠参考面板中认知弹性相关的代谢相关蛋白网络
08 (INT J SURGS) 血小板浓缩物衍生的细胞外囊泡促进成年海马神经发生
一起来看看本期的蛋白质组学精选优质文献吧!

1. (Nature,IF:50.5) iPEX技术通过组织扩展实现微米分辨率的深度空间蛋白质组学
想象一下,如果我们能像在地图上找位置一样,精确知道每种蛋白质在组织中的分布,那将多么有助于疾病研究和诊断。近日,西湖大学邹贻龙团队与Kiryl D. Piatkevich团队在《Nature》杂志上发表了一项名为iPEX的新技术,让这一愿景成为现实。
iPEX的全称是“通过组织扩展实现微米分辨率的深度空间蛋白质组学”。它的核心原理是将组织样本用一种特殊的水凝胶处理,使其均匀膨胀,就像泡发银耳一样变大,再用质谱成像技术对膨胀后的组织进行分析。这种方法不仅提高了空间分辨率,还大幅提升了蛋白质检测的灵敏度。
在实验中,研究人员以小鼠视网膜为模型,成功绘制出高分辨率的蛋白质分布图,甚至可以区分单个细胞层和微小的突触结构。这项技术还适用于大脑、肝脏、肠道等多种组织,以及人类脑类器官,能同时检测600到1500种蛋白质。
更令人振奋的是,iPEX技术在阿尔茨海默病研究中展现出巨大潜力。科学家发现,在患病小鼠的大脑中,一种名为ACAA1A的蛋白质在疾病早期就显著减少。这种蛋白质参与维持大脑中重要脂肪酸的平衡,其缺失可能导致神经细胞膜功能异常,从而促进疾病发展。
iPEX不仅突破了传统蛋白质检测的分辨率和灵敏度限制,还为研究复杂组织结构中的蛋白质功能提供了强大工具。未来,这项技术有望推动精准医学的发展,帮助科学家更早发现疾病、理解疾病机制,并开发更有效的治疗方法。

原文链接: https://www.nature.com/articles/s41586-025-09734-0

2. (Nature,IF:50.5) 猪到人尸体肾异种移植的多组学分析

3. (Nature Neuroscience,IF:21.2) 雌激素调节奖励预测误差和强化学习


4.(Nature Communications,IF:14.7) GroEL/ES分子伴侣展开并在核糖体上封装新生蛋白质


5. (Nature Communications,IF:14.7) 表面蛋白表达的变化导致锥虫在宿主细胞感染过程中形成异质群体
麦吉尔大学寄生虫学研究所团队发布克氏锥虫Sylvio X10株端粒到端粒完整基因组,31条染色体含2934个多基因家族(MGF)成员,占基因总数21%。TMT定量蛋白组显示转唾液酸酶(TS)、黏蛋白、MASP等毒力因子在感染型锥鞭毛体(CT)显著上调,且表达位点分散于各染色体。
作者设计MGF-seq追踪CT连续感染心肌细胞四代,发现82%的MGF转录本丰度动态变化,单群体可表达1300余种MGF,提示每轮感染均快速生成表面蛋白异质群体。酵母表面展示并用慢性Chagas患者血清筛选,约150种MGF被抗体识别,TS优势但N端序列保守度低,交叉反应有限。功能实验显示第一代CT侵袭率最高,随MGF多样性增加侵袭效率呈细胞类型依赖波动,而每代CT产量递增,表明表面抗原重编既助力免疫逃逸也优化宿主适应。
该研究阐明MGF基因组结构与表达噪声共同驱动克氏锥虫群体异质性,为疫苗和诊断靶点选择提供高分辨率图谱。


6. (Nature Communications,IF:14.7) Koina:使机器学习普及化用于蛋白质组学研究


7. (Alzheimer's & Dementia,IF:13.0)Nr1d1转录因子结合位点的遗传变异塑造了与阿尔茨海默病小鼠参考面板中认知弹性相关的代谢相关蛋白网络


8. (Biomaterials,IF:12.8) 血小板浓缩物衍生的细胞外囊泡促进成年海马神经发生

声明:本文内容基于期刊公开信息整理,中文解读及科普文字由多个AI 助手生成,旨在帮助大众快速理解前沿研究,不构成任何专业建议或诊断依据。如需实验或临床应用,请以原始文献与专业人士意见为准。








