
01 αSyn与线粒体膜和蛋白的广泛相互作用
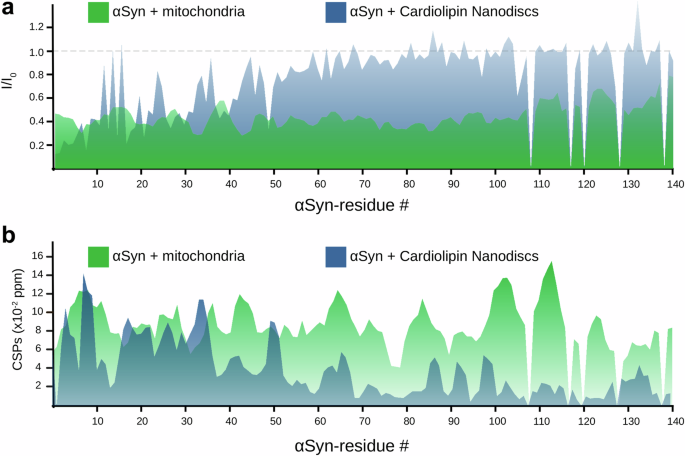
图2 Transient residue-resolved interaction of mitochondria with αSyn.
02 αSyn特异性结合线粒体能量代谢蛋白(AK2与ATP合酶)
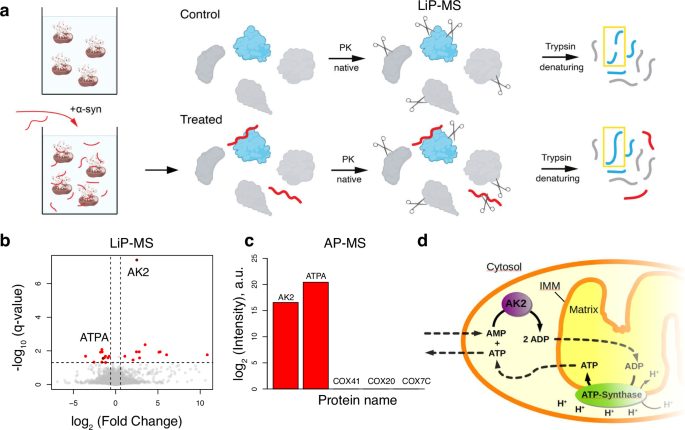
图3 Identification of αSyn interaction partners from the mitochondrial proteome.
03 αSyn的C端是与AK2相互作用的关键区域
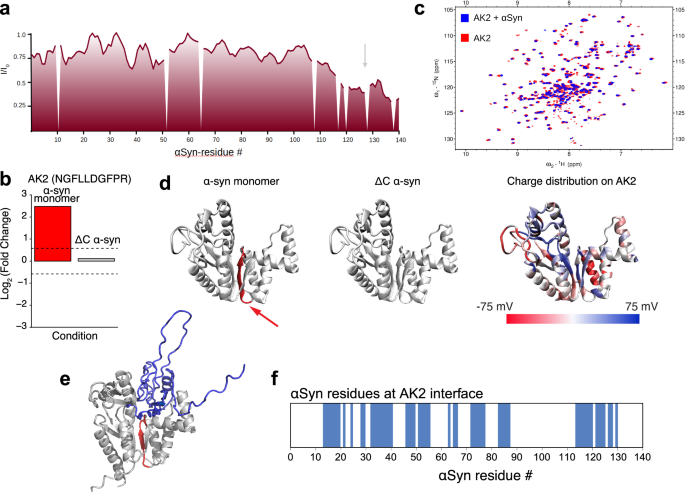
图4 The interaction between AK2 and αSyn is facilitated through the C-terminal region of αSyn, affecting widespread small structural changes on AK2, including the hinge region in particular.
04 αSyn调控AK2活性依赖其构象
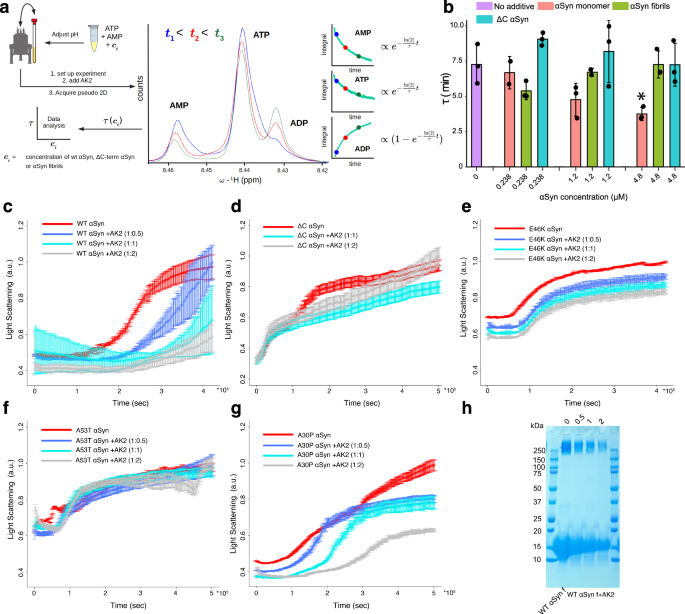
图5 αSyn enhances AK2 catalytic activity.
05 αSyn聚集对ATP合成与水解的影响
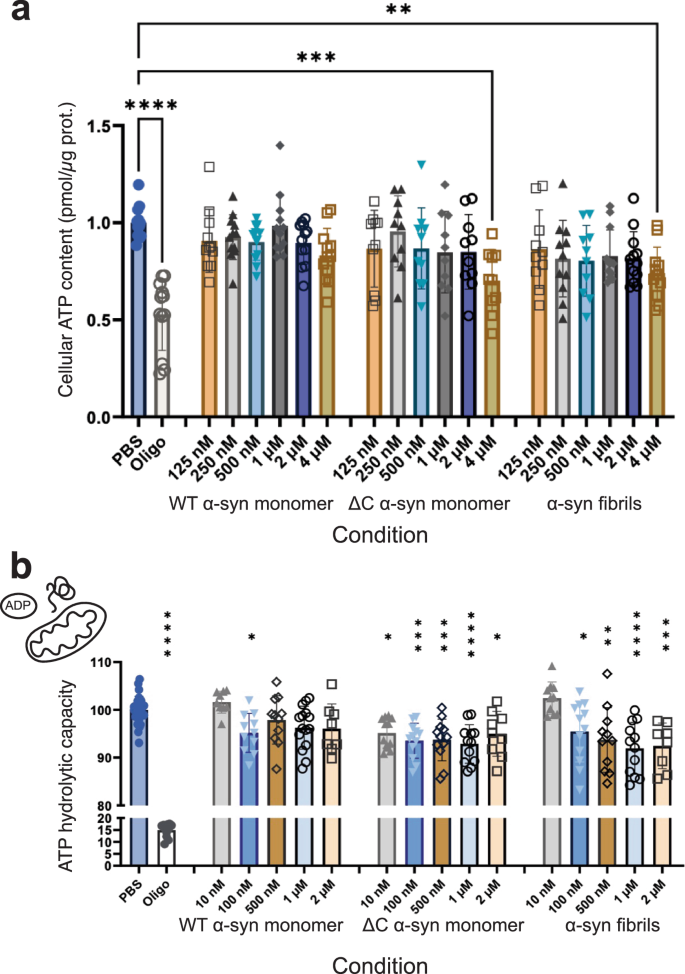
图6 Influence of αSyn on ATP hydrolysis in cells.
06 小结
免责声明:本篇文章由人工智能(ChatGPT 5)撰写,内容基于相关文献、研究成果和现有科技进展的综合分析。虽然我们力求确保文章信息的准确性和可靠性,但由于AI生成内容的局限性,本文的观点和见解仅供参考。读者在应用或引用本文内容时,请自行核实相关信息和数据的有效性。我们不对任何因使用本文内容所导致的直接或间接损失承担责任。

01 αSyn与线粒体膜和蛋白的广泛相互作用

图2 Transient residue-resolved interaction of mitochondria with αSyn.
02 αSyn特异性结合线粒体能量代谢蛋白(AK2与ATP合酶)

图3 Identification of αSyn interaction partners from the mitochondrial proteome.
03 αSyn的C端是与AK2相互作用的关键区域

图4 The interaction between AK2 and αSyn is facilitated through the C-terminal region of αSyn, affecting widespread small structural changes on AK2, including the hinge region in particular.
04 αSyn调控AK2活性依赖其构象

图5 αSyn enhances AK2 catalytic activity.
05 αSyn聚集对ATP合成与水解的影响

图6 Influence of αSyn on ATP hydrolysis in cells.
06 小结
免责声明:本篇文章由人工智能(ChatGPT 5)撰写,内容基于相关文献、研究成果和现有科技进展的综合分析。虽然我们力求确保文章信息的准确性和可靠性,但由于AI生成内容的局限性,本文的观点和见解仅供参考。读者在应用或引用本文内容时,请自行核实相关信息和数据的有效性。我们不对任何因使用本文内容所导致的直接或间接损失承担责任。








