研究背景
胆囊癌(GBC)是胆道系统中最常见的恶性肿瘤,其恶性程度极高,发病隐匿且进展飞速。目前,仅少数早期患者可通过手术治愈,而对于大多数发现即晚期的患者,传统化疗方案获益有限,5年生存率不足10%。
虽然既往基因组研究揭示了TP53、ErbB2等关键驱动变异,但单纯依靠DNA层面的信息,难以解释胆囊癌极易发生肝侵袭、对常规靶向药响应率低等临床难题。临床上急需一份从基因到蛋白的全维度“高清地图”,为胆囊癌的精准分层与新型靶点开发提供底层逻辑。
2026年1月8日,复旦大学附属中山医院樊嘉院士、高强教授团队,联合中国科学院上海药物研究所周虎研究员等,在 Cancer Cell 发表了目前全球规模最大的胆囊癌多组学研究,题目为:“Integrative proteogenomic analysis provides molecular insights and clinical significance in gallbladder cancer”,为破解这一顽疾提供了前所未有的深度视角。

文章标题
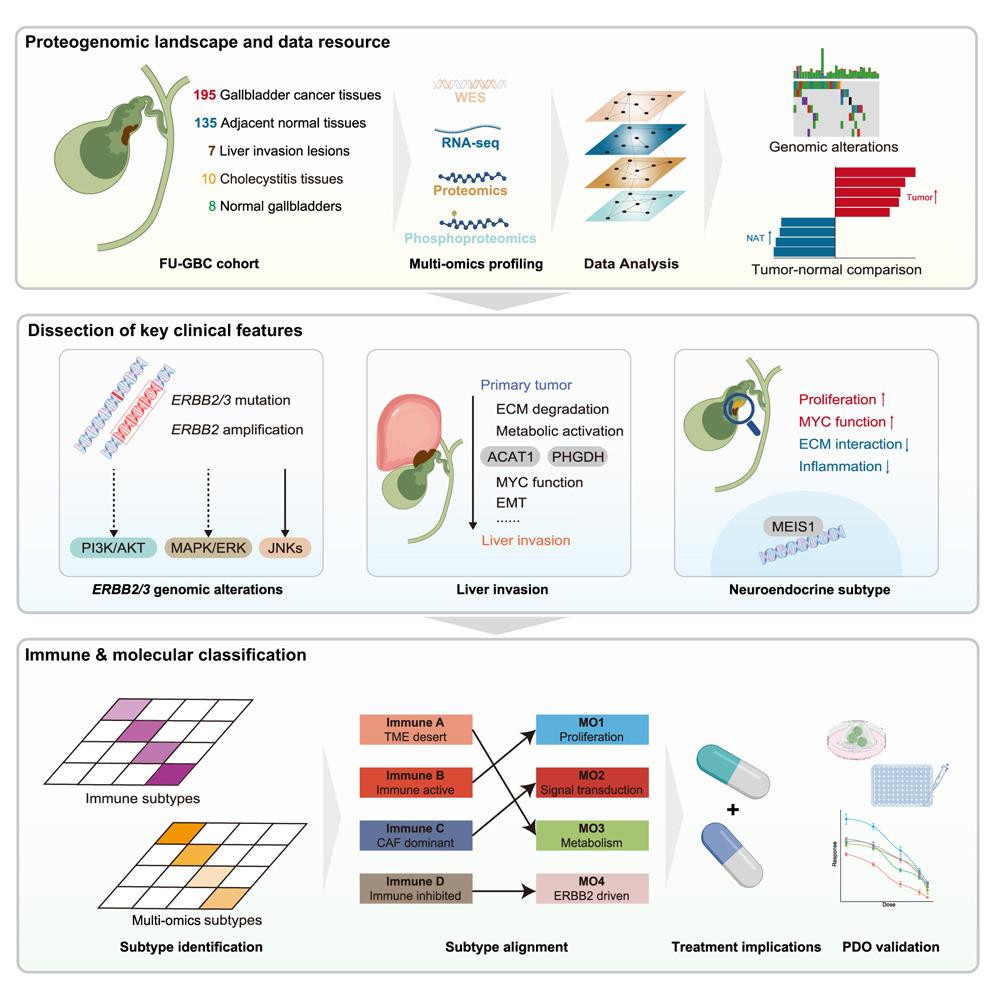
Graphical abstract
研究结果
01. FU-GBC多组学队列构建与胆囊癌关键基因组/蛋白基因组特征概览
研究团队建立了目前规模最大的胆囊癌多组学队列(FU-GBC),从中国四家医院收集手术切除样本,质控后纳入195例胆囊癌(GBC)与166例癌旁正常(NAT),并完成WES(肿瘤n=167)、RNA-seq(肿瘤n=135)、蛋白组(肿瘤n=193)和磷酸化蛋白组(肿瘤n=193)的多组学检测,同时还测了7例肝侵袭灶、10例胆囊炎与8例正常胆囊样本用于对照/扩展分析(Fig.1A)。
在此基础上,作者先给出GBC的高频驱动突变谱(TP53 47.9%)并展示显著的共突变关系(如SMAD4-ARID1A、SMAD4-ATM等)(Fig.1B),随后系统评估突变对mRNA/蛋白丰度的cis/trans影响(Fig.1C)并指出TP53突变与EPHA2及整合素家族上调相关、EPHA2突变也可上调整合素,提示可能存在“TP53→EPHA2→整合素”联动轴(Fig.1D);通路层面进一步总结TP53突变激活细胞周期/DNA损伤应答等程序、ELF3突变更偏向代谢重编程等(Fig.1E);基因组结构变异方面,作者描绘了GBC的广泛CNV图谱(如1q/8q/12p/17q/19q扩增涉及MDM2/4、MYC、ERBB2、CCNE1等,6p/8p/9p/15p缺失涉及HLA/CDKN2A/B等)(Fig.1F),并进一步从扩增峰中筛出同时在mRNA与蛋白层面呈正相关的顺式效应基因,显示这些CNV事件富集于FGFR1、RAS、ERBB2与MYC靶基因等致癌通路,强调其潜在驱动作用(Fig.1G)。
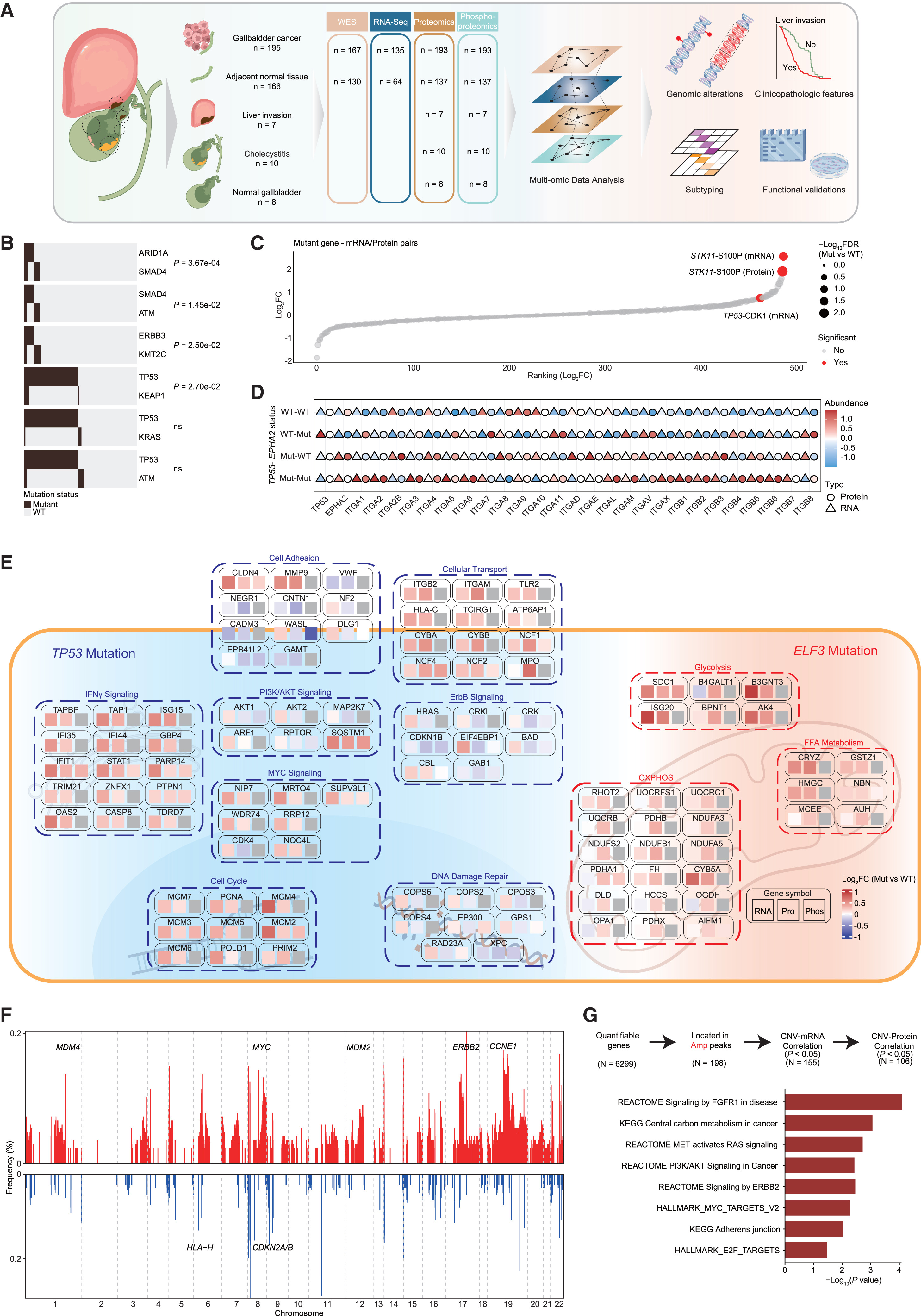
Fig.1 Comprehensive genomic profiling of FU-GBC cohort
02. 信号重塑:ErbB家族的“非典型”运作模式
该队列中,ErbB家族的改变以ErbB2拷贝数扩增(n=23)和ErbB3突变(n=14)/扩增(n=13)为主,EGFR/ErbB4改变较少(Fig.2A);ErbB2扩增会显著提高其自身mRNA、蛋白和磷酸化水平且不明显影响其他ErbB成员(Fig.2B)。传统认为ErbB2扩增会激活PI3K/AKT经典通路。然而,基于蛋白组/磷酸化蛋白组的ssGSEA显示,胆囊癌中ErbB2扩增反而表现出对经典通路的抑制,转而通过增强MYC活性和细胞周期调节来驱动肿瘤。这种信号传导的“重新连线”解释了为何常规HER2抑制剂在胆囊癌中效果不佳(Fig.2C、D)。
在突变层面,蛋白组提示ErbB3受体结构域(I/III)突变更可能增强下游ErbB信号活性(Fig.2E);结构建模显示ErbB3 P306R(domain II)可通过引入氢键供体、缩短与ErbB2II域结合区距离来增强异源二聚体稳定性/亲和力(Fig.2F-G);对跨膜结构域(TMD)突变,预测结果表明ErbB2 S656F及部分ErbB3 TMD突变(如V653E、R667L)会缩短二聚体距离并改变极性片段(Fig.2H-I)。功能验证显示这些TMD突变体会提高MYC活性并更偏向JNK信号(p-JNK升高),KSEA也显示突变细胞系JNK1/2/3活性高于AKT/ERK(Fig.2J-K)。揭示了ErbB2/ErbB3改变可通过“二聚体增强+信号偏好转向”产生非经典致癌效应并带来治疗启示。
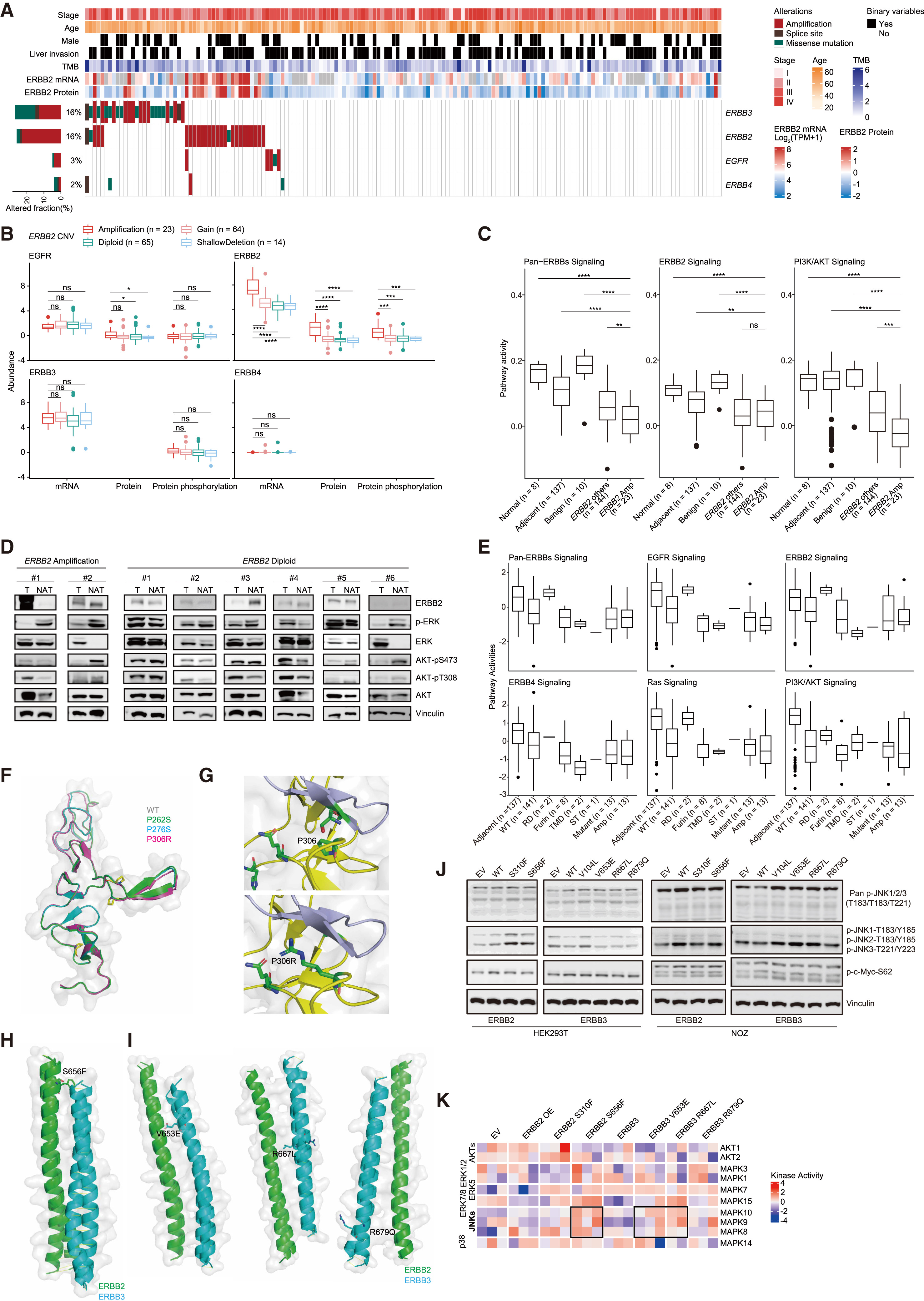
Fig.2 Impact of genomic ErbB2/ErbB3 alterations on GBC
03. 肝侵袭机制:ACAT1与PHGDH驱动的代谢重构
胆囊癌极易侵袭肝脏(LI),在FU-GBC队列中LI发生率高且与更差生存显著相关,并据此设计了7例配对NAT–原发灶–LI灶的探索队列与11例LI阳性验证队列进行蛋白组学解析(Fig.3A);基因组层面,LI阳性更富集MACF1、PXDN、ADGRV1、NF1等突变,而非侵袭更常见MAGEC1突变(Fig.3B),CNV显示MYC扩增在LI原发肿瘤更常见(而ERBB2扩增差异不明显)(Fig.3C)。
蛋白组学比较进一步表明,“会发生LI的原发灶”已呈现更强的EMT/pEMT与ECM-细胞互作/降解特征,同时免疫相关标志降低(Fig.3D),其富集通路包括EMT、ECM降解与亚油酸代谢,而非侵袭原发灶更偏向氧化磷酸化(Fig.3E);当真正形成LI灶时,相比配对原发灶,LI灶进一步表现为代谢相关蛋白上调、免疫相关蛋白下调(Fig.3F),并在通路上突出甾醇/胆固醇代谢与MYC激活(Fig.3G)。
最后,作者从两套LI队列中筛到在侵袭灶一致上调的候选蛋白并做功能验证,证明ACAT1与PHGDH是与LI相关的代谢依赖点,敲低任意其中一个均可抑制胆囊癌细胞增殖与侵袭(Fig.3H)。
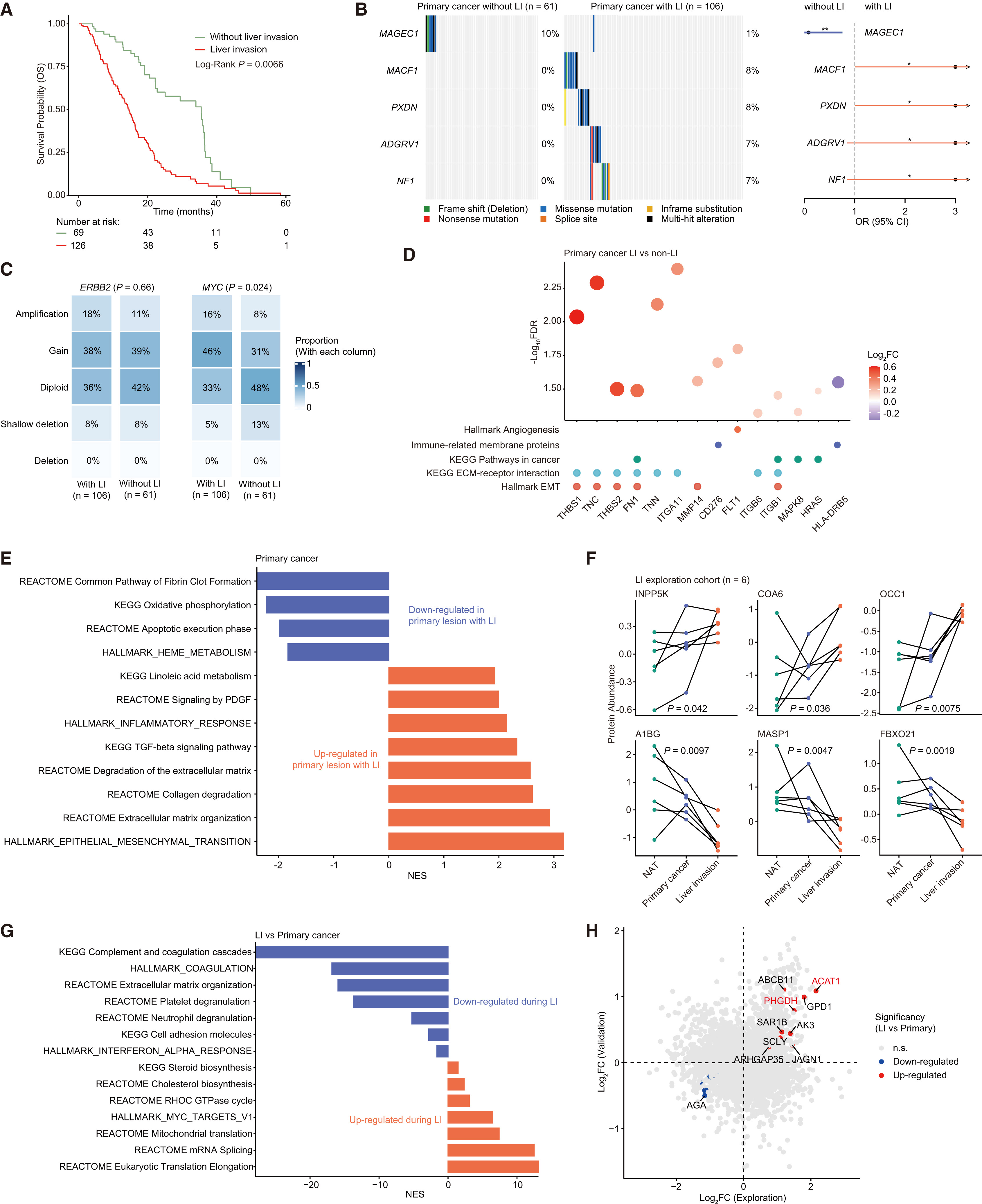
Fig.3 Analysis of liver invasion behavior in GBC
04. 胆囊癌肿瘤免疫微环境(TIME)四亚型
基于BayesDeBulk将蛋白组与转录组整合去卷积TIME组成,并按免疫细胞浸润与免疫模块活性无监督聚类,将FU-GBC队列划分为4个TIME亚型(A–D):A型免疫浸润低、更像“免疫荒漠”;B型免疫效应细胞(如CD8+T、NK、M1巨噬)最丰富、免疫模块活性最高,呈“免疫激活”;C型以CAF/基质为主并伴中等免疫效应细胞;D型肿瘤成分最高且免疫检查点表达最高,结合髓系/免疫调控标志物富集更符合“免疫抑制”表型(Fig.4A)。
通路层面四亚型功能明显不同:A偏增殖,B偏抗原呈递与IL信号,C富集细胞连接/ECM形成与血管生成,D富集ECM降解、缺氧、氨基酸代谢与N-糖基化等,并与更差预后和更高转移潜能相关;且D相比C进一步表现为整合素、N-糖基化相关蛋白、免疫检查点与免疫抑制性代谢酶更高(Fig.4B-C)。
在基因组关联上,各亚型TMB无显著差异但染色体不稳定性在A/C/D高于B,并且一个关键事件是chr18q缺失在B型更少见(Fig.4E),chr18q缺失与免疫评分下降显著相关(主要由CD8+T、NK、M1巨噬减少驱动,Fig.4F),同时伴随增殖与MYC活性增强及多条免疫通路(如IL-6、TLR、TNFα)下调(Fig.4G),多组学证据进一步提示其可通过多机制共同破坏先天与适应性免疫应答(Fig.4H),因此chr18q缺失可能成为反映/预测GBC抗肿瘤免疫活性的潜在生物标志物。
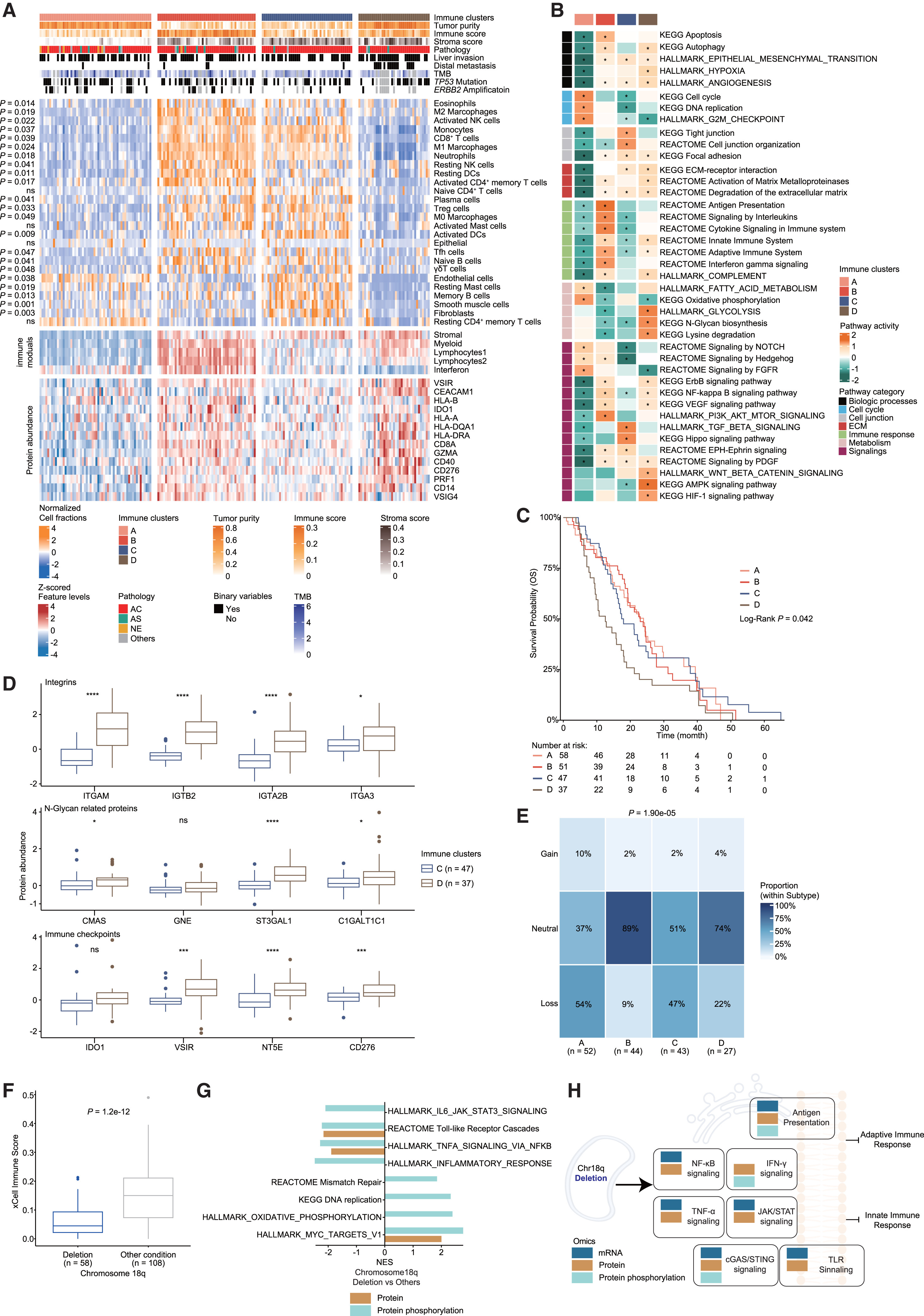
Fig.4 Immune landscape of FU-GBC cohort
05. 多组学分型(MO1–MO4)及其预后差异与分型驱动的治疗策略框架
采用“两步法”(MOVICS聚类+XGBoost分类器)在FU-GBC队列中得到4个稳健的多组学亚型MO1–MO4(Fig.5A),并显示不同亚型预后显著不同、其中MO4生存最差(Fig.5B)。
功能层面各亚型具有清晰生物学特征:MO1偏增殖/DDR/炎症相关,MO2偏致癌信号(JAK-STAT、ErbB、Ras等)驱动,MO3偏代谢与MYC活化,MO4则表现为ErbB上游信号活跃(GRB7富集、PTK6激活)、糖基化相关通路富集且ErbB2扩增频率最高(Fig.5C);基因组层面,尽管TMB/新抗原负荷无显著差异,但MO3染色体不稳定性更高,并呈现CTNNB1、SMAD4、ELF3等突变及ErbB2扩增的亚型偏好,从而与功能谱互补解释异质性(Fig.5D);表型上,MO4的神经内分泌(NE)功能更强(Fig.5E),而侵袭相关方面MO2的cEMT分数与侵袭评分更高(Fig.5F)。
为验证分型的可操作性,作者将训练好的XGBoost模型用于患者来源类器官分型(Fig.5G),并观察到药敏与亚型特征相匹配(如MO1对奥沙利铂更敏感、MO2对多激酶抑制剂更敏感、MO3对MYC或代谢抑制剂更敏感、MO4对HDAC抑制剂更敏感)(Fig.5H)。
最终作者整合TIME亚型、多组学分型与药敏推断,提出一个面向临床的“分型—用药(含联合治疗)”策略框架:MO1倾向化疗/细胞周期抑制与免疫调节,MO2倾向RTK/信号通路抑制,MO3倾向代谢或MYC相关抑制,MO4倾向ErbB2靶向联合免疫调节并可考虑糖酵解抑制(Fig.5I)。

Fig.5 Multi-omics classification of FU-GBC cohort
06. 神经内分泌型胆囊癌(NE-GBC)的多组学特征与MEIS1 驱动的转分化机制
在主要病理亚型比较中,NE-GBC以 NCAM1 蛋白和 CHGB mRNA 等神经内分泌标志物高表达为特征,并且在转录组、蛋白组、磷酸化蛋白组中都形成独立聚类,显示其分子层面“独立成类”的本质(Fig.6A)。
基因组层面NE-GBC 的 TMB 并不更高,但染色体不稳定性更强、CNV 负担更大,出现如 3p/8q(含 MYC)扩增以及 6q、16q 缺失等特征性改变(Fig.6B),并指出 6 号染色体缺失影响免疫相关基因、16q 缺失影响黏附/抑癌相关基因,可能共同促成其高恶性表型(Fig.6C)。
蛋白组功能分析进一步显示NE-GBC 相比其他亚型更显著增强增殖、DNA 损伤修复与细胞内应激相关过程(Fig.6D)。
机制上,作者通过转录因子活性推断与多组学相关性分析提出MEIS1 是 NE-GBC 的关键调控枢纽,可能与 MYC 协同维持 NE 表型(Fig.6E–G),并用功能实验验证:在 AC-GBC 细胞中稳定过表达 MEIS1 后,NE 标记 CHGB 及多种 NE 相关转录因子(如 ASCL1/2、NEUROG1、ATOH1)随时间显著上调,提示 MEIS1 具备推动 AC 向 NE-样状态“重编程/转分化”的能力(Fig.6E–F),同时与 MEIS1 相关的多组学特征提示其可能驱动 ECM/黏附骨架重塑、PI3K/AKT 激活与轴突导向等过程(Fig.6G)。
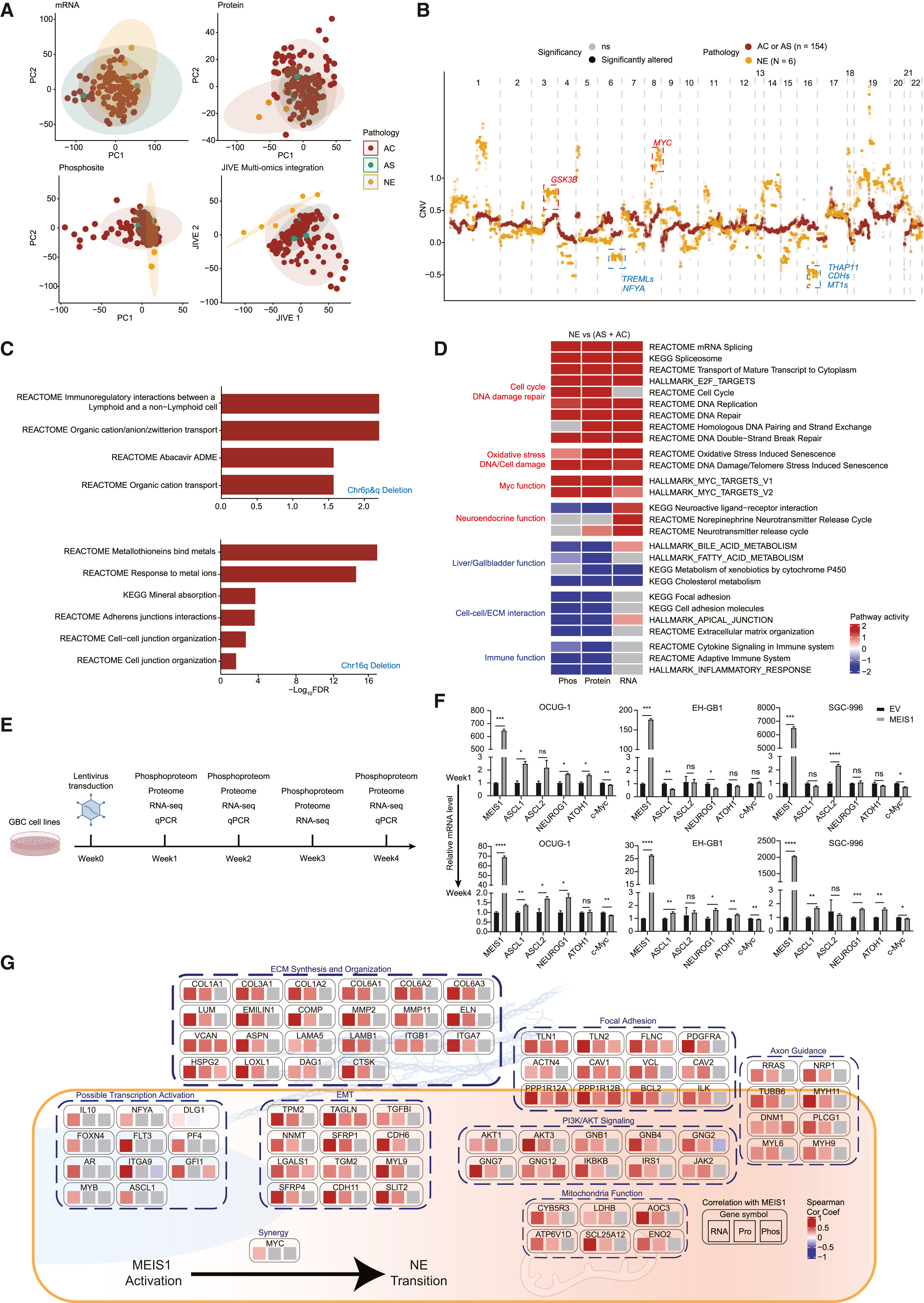
Fig.6 Comprehensive functional depiction of neuroendocrine GBC
总结与展望
该研究建立了全球目前规模最大的胆囊癌(GBC)多组学图谱(FU-GBC队列),通过对195名患者的肿瘤组织进行蛋白质组、磷酸化蛋白质组、转录组及外显子组的整合分析,深度揭示了胆囊癌独特的分子特征。研究不仅颠覆了传统认知,发现ErbB2扩增在胆囊癌中表现为抑制经典PI3K/AKT通路、转而激活MYC和细胞周期的“非典型信号传导”,还锁定了ACAT1和PHGDH作为驱动肝侵袭的关键代谢因子,并根据多组学特征将胆囊癌精准划分为四种亚型(MO1-MO4),同时首次阐明了MEIS1在诱导罕见神经内分泌癌表型转化中的核心作用,为胆囊癌的临床精准诊疗和新药研发提供了极其宝贵的科学资源。
原文链接:https://doi.org/10.1016/j.ccell.2025.12.014
研究背景
胆囊癌(GBC)是胆道系统中最常见的恶性肿瘤,其恶性程度极高,发病隐匿且进展飞速。目前,仅少数早期患者可通过手术治愈,而对于大多数发现即晚期的患者,传统化疗方案获益有限,5年生存率不足10%。
虽然既往基因组研究揭示了TP53、ErbB2等关键驱动变异,但单纯依靠DNA层面的信息,难以解释胆囊癌极易发生肝侵袭、对常规靶向药响应率低等临床难题。临床上急需一份从基因到蛋白的全维度“高清地图”,为胆囊癌的精准分层与新型靶点开发提供底层逻辑。
2026年1月8日,复旦大学附属中山医院樊嘉院士、高强教授团队,联合中国科学院上海药物研究所周虎研究员等,在 Cancer Cell 发表了目前全球规模最大的胆囊癌多组学研究,题目为:“Integrative proteogenomic analysis provides molecular insights and clinical significance in gallbladder cancer”,为破解这一顽疾提供了前所未有的深度视角。

文章标题

Graphical abstract
研究结果
01. FU-GBC多组学队列构建与胆囊癌关键基因组/蛋白基因组特征概览
研究团队建立了目前规模最大的胆囊癌多组学队列(FU-GBC),从中国四家医院收集手术切除样本,质控后纳入195例胆囊癌(GBC)与166例癌旁正常(NAT),并完成WES(肿瘤n=167)、RNA-seq(肿瘤n=135)、蛋白组(肿瘤n=193)和磷酸化蛋白组(肿瘤n=193)的多组学检测,同时还测了7例肝侵袭灶、10例胆囊炎与8例正常胆囊样本用于对照/扩展分析(Fig.1A)。
在此基础上,作者先给出GBC的高频驱动突变谱(TP53 47.9%)并展示显著的共突变关系(如SMAD4-ARID1A、SMAD4-ATM等)(Fig.1B),随后系统评估突变对mRNA/蛋白丰度的cis/trans影响(Fig.1C)并指出TP53突变与EPHA2及整合素家族上调相关、EPHA2突变也可上调整合素,提示可能存在“TP53→EPHA2→整合素”联动轴(Fig.1D);通路层面进一步总结TP53突变激活细胞周期/DNA损伤应答等程序、ELF3突变更偏向代谢重编程等(Fig.1E);基因组结构变异方面,作者描绘了GBC的广泛CNV图谱(如1q/8q/12p/17q/19q扩增涉及MDM2/4、MYC、ERBB2、CCNE1等,6p/8p/9p/15p缺失涉及HLA/CDKN2A/B等)(Fig.1F),并进一步从扩增峰中筛出同时在mRNA与蛋白层面呈正相关的顺式效应基因,显示这些CNV事件富集于FGFR1、RAS、ERBB2与MYC靶基因等致癌通路,强调其潜在驱动作用(Fig.1G)。

Fig.1 Comprehensive genomic profiling of FU-GBC cohort
02. 信号重塑:ErbB家族的“非典型”运作模式
该队列中,ErbB家族的改变以ErbB2拷贝数扩增(n=23)和ErbB3突变(n=14)/扩增(n=13)为主,EGFR/ErbB4改变较少(Fig.2A);ErbB2扩增会显著提高其自身mRNA、蛋白和磷酸化水平且不明显影响其他ErbB成员(Fig.2B)。传统认为ErbB2扩增会激活PI3K/AKT经典通路。然而,基于蛋白组/磷酸化蛋白组的ssGSEA显示,胆囊癌中ErbB2扩增反而表现出对经典通路的抑制,转而通过增强MYC活性和细胞周期调节来驱动肿瘤。这种信号传导的“重新连线”解释了为何常规HER2抑制剂在胆囊癌中效果不佳(Fig.2C、D)。
在突变层面,蛋白组提示ErbB3受体结构域(I/III)突变更可能增强下游ErbB信号活性(Fig.2E);结构建模显示ErbB3 P306R(domain II)可通过引入氢键供体、缩短与ErbB2II域结合区距离来增强异源二聚体稳定性/亲和力(Fig.2F-G);对跨膜结构域(TMD)突变,预测结果表明ErbB2 S656F及部分ErbB3 TMD突变(如V653E、R667L)会缩短二聚体距离并改变极性片段(Fig.2H-I)。功能验证显示这些TMD突变体会提高MYC活性并更偏向JNK信号(p-JNK升高),KSEA也显示突变细胞系JNK1/2/3活性高于AKT/ERK(Fig.2J-K)。揭示了ErbB2/ErbB3改变可通过“二聚体增强+信号偏好转向”产生非经典致癌效应并带来治疗启示。

Fig.2 Impact of genomic ErbB2/ErbB3 alterations on GBC
03. 肝侵袭机制:ACAT1与PHGDH驱动的代谢重构
胆囊癌极易侵袭肝脏(LI),在FU-GBC队列中LI发生率高且与更差生存显著相关,并据此设计了7例配对NAT–原发灶–LI灶的探索队列与11例LI阳性验证队列进行蛋白组学解析(Fig.3A);基因组层面,LI阳性更富集MACF1、PXDN、ADGRV1、NF1等突变,而非侵袭更常见MAGEC1突变(Fig.3B),CNV显示MYC扩增在LI原发肿瘤更常见(而ERBB2扩增差异不明显)(Fig.3C)。
蛋白组学比较进一步表明,“会发生LI的原发灶”已呈现更强的EMT/pEMT与ECM-细胞互作/降解特征,同时免疫相关标志降低(Fig.3D),其富集通路包括EMT、ECM降解与亚油酸代谢,而非侵袭原发灶更偏向氧化磷酸化(Fig.3E);当真正形成LI灶时,相比配对原发灶,LI灶进一步表现为代谢相关蛋白上调、免疫相关蛋白下调(Fig.3F),并在通路上突出甾醇/胆固醇代谢与MYC激活(Fig.3G)。
最后,作者从两套LI队列中筛到在侵袭灶一致上调的候选蛋白并做功能验证,证明ACAT1与PHGDH是与LI相关的代谢依赖点,敲低任意其中一个均可抑制胆囊癌细胞增殖与侵袭(Fig.3H)。

Fig.3 Analysis of liver invasion behavior in GBC
04. 胆囊癌肿瘤免疫微环境(TIME)四亚型
基于BayesDeBulk将蛋白组与转录组整合去卷积TIME组成,并按免疫细胞浸润与免疫模块活性无监督聚类,将FU-GBC队列划分为4个TIME亚型(A–D):A型免疫浸润低、更像“免疫荒漠”;B型免疫效应细胞(如CD8+T、NK、M1巨噬)最丰富、免疫模块活性最高,呈“免疫激活”;C型以CAF/基质为主并伴中等免疫效应细胞;D型肿瘤成分最高且免疫检查点表达最高,结合髓系/免疫调控标志物富集更符合“免疫抑制”表型(Fig.4A)。
通路层面四亚型功能明显不同:A偏增殖,B偏抗原呈递与IL信号,C富集细胞连接/ECM形成与血管生成,D富集ECM降解、缺氧、氨基酸代谢与N-糖基化等,并与更差预后和更高转移潜能相关;且D相比C进一步表现为整合素、N-糖基化相关蛋白、免疫检查点与免疫抑制性代谢酶更高(Fig.4B-C)。
在基因组关联上,各亚型TMB无显著差异但染色体不稳定性在A/C/D高于B,并且一个关键事件是chr18q缺失在B型更少见(Fig.4E),chr18q缺失与免疫评分下降显著相关(主要由CD8+T、NK、M1巨噬减少驱动,Fig.4F),同时伴随增殖与MYC活性增强及多条免疫通路(如IL-6、TLR、TNFα)下调(Fig.4G),多组学证据进一步提示其可通过多机制共同破坏先天与适应性免疫应答(Fig.4H),因此chr18q缺失可能成为反映/预测GBC抗肿瘤免疫活性的潜在生物标志物。

Fig.4 Immune landscape of FU-GBC cohort
05. 多组学分型(MO1–MO4)及其预后差异与分型驱动的治疗策略框架
采用“两步法”(MOVICS聚类+XGBoost分类器)在FU-GBC队列中得到4个稳健的多组学亚型MO1–MO4(Fig.5A),并显示不同亚型预后显著不同、其中MO4生存最差(Fig.5B)。
功能层面各亚型具有清晰生物学特征:MO1偏增殖/DDR/炎症相关,MO2偏致癌信号(JAK-STAT、ErbB、Ras等)驱动,MO3偏代谢与MYC活化,MO4则表现为ErbB上游信号活跃(GRB7富集、PTK6激活)、糖基化相关通路富集且ErbB2扩增频率最高(Fig.5C);基因组层面,尽管TMB/新抗原负荷无显著差异,但MO3染色体不稳定性更高,并呈现CTNNB1、SMAD4、ELF3等突变及ErbB2扩增的亚型偏好,从而与功能谱互补解释异质性(Fig.5D);表型上,MO4的神经内分泌(NE)功能更强(Fig.5E),而侵袭相关方面MO2的cEMT分数与侵袭评分更高(Fig.5F)。
为验证分型的可操作性,作者将训练好的XGBoost模型用于患者来源类器官分型(Fig.5G),并观察到药敏与亚型特征相匹配(如MO1对奥沙利铂更敏感、MO2对多激酶抑制剂更敏感、MO3对MYC或代谢抑制剂更敏感、MO4对HDAC抑制剂更敏感)(Fig.5H)。
最终作者整合TIME亚型、多组学分型与药敏推断,提出一个面向临床的“分型—用药(含联合治疗)”策略框架:MO1倾向化疗/细胞周期抑制与免疫调节,MO2倾向RTK/信号通路抑制,MO3倾向代谢或MYC相关抑制,MO4倾向ErbB2靶向联合免疫调节并可考虑糖酵解抑制(Fig.5I)。

Fig.5 Multi-omics classification of FU-GBC cohort
06. 神经内分泌型胆囊癌(NE-GBC)的多组学特征与MEIS1 驱动的转分化机制
在主要病理亚型比较中,NE-GBC以 NCAM1 蛋白和 CHGB mRNA 等神经内分泌标志物高表达为特征,并且在转录组、蛋白组、磷酸化蛋白组中都形成独立聚类,显示其分子层面“独立成类”的本质(Fig.6A)。
基因组层面NE-GBC 的 TMB 并不更高,但染色体不稳定性更强、CNV 负担更大,出现如 3p/8q(含 MYC)扩增以及 6q、16q 缺失等特征性改变(Fig.6B),并指出 6 号染色体缺失影响免疫相关基因、16q 缺失影响黏附/抑癌相关基因,可能共同促成其高恶性表型(Fig.6C)。
蛋白组功能分析进一步显示NE-GBC 相比其他亚型更显著增强增殖、DNA 损伤修复与细胞内应激相关过程(Fig.6D)。
机制上,作者通过转录因子活性推断与多组学相关性分析提出MEIS1 是 NE-GBC 的关键调控枢纽,可能与 MYC 协同维持 NE 表型(Fig.6E–G),并用功能实验验证:在 AC-GBC 细胞中稳定过表达 MEIS1 后,NE 标记 CHGB 及多种 NE 相关转录因子(如 ASCL1/2、NEUROG1、ATOH1)随时间显著上调,提示 MEIS1 具备推动 AC 向 NE-样状态“重编程/转分化”的能力(Fig.6E–F),同时与 MEIS1 相关的多组学特征提示其可能驱动 ECM/黏附骨架重塑、PI3K/AKT 激活与轴突导向等过程(Fig.6G)。

Fig.6 Comprehensive functional depiction of neuroendocrine GBC
总结与展望
该研究建立了全球目前规模最大的胆囊癌(GBC)多组学图谱(FU-GBC队列),通过对195名患者的肿瘤组织进行蛋白质组、磷酸化蛋白质组、转录组及外显子组的整合分析,深度揭示了胆囊癌独特的分子特征。研究不仅颠覆了传统认知,发现ErbB2扩增在胆囊癌中表现为抑制经典PI3K/AKT通路、转而激活MYC和细胞周期的“非典型信号传导”,还锁定了ACAT1和PHGDH作为驱动肝侵袭的关键代谢因子,并根据多组学特征将胆囊癌精准划分为四种亚型(MO1-MO4),同时首次阐明了MEIS1在诱导罕见神经内分泌癌表型转化中的核心作用,为胆囊癌的临床精准诊疗和新药研发提供了极其宝贵的科学资源。
原文链接:https://doi.org/10.1016/j.ccell.2025.12.014