西湖欧上期举办的《Nature一作来袭——单细胞空间蛋白质组学研究思路揭秘》线上直播,邀请了德国马克斯·普朗克生物化学研究所 Matthias Mann 团队的 Thierry Nordmann 博士(项目组负责人)、Florian Rosenberger 博士(博士后研究员)、孙耀庭博士(博士后研究员)和西湖大学王瑛睿博士(副研究员),共同探讨单细胞深度视觉蛋白质组学(scDVP)如何在复杂的组织环境中直接揭示动态生物过程和疾病进展。
让我们一起来看看直播的精彩回放吧!
01
Thierry Nordmann
马克斯·普朗克生物化学研究所 项目组负责人
Spatial Proteomics for Precision Medicine in Dermatology
讲座概要:研究利用深度视觉蛋白质组学(deep visual proteomics,DVP)技术,对中毒性表皮坏死松解症(TEN)患者的皮肤活检样本进行分析,揭示了干扰素及其下游的JAK-STAT信号通路主导了TEN中的炎症特征。研究揭示了JAK抑制在体外、体内(小鼠模型)及临床患者均可改善疾病表型,这表明JAK抑制剂有望成为TEN的有效疗法。
点击观看直播回放片段
精彩瞬间
1
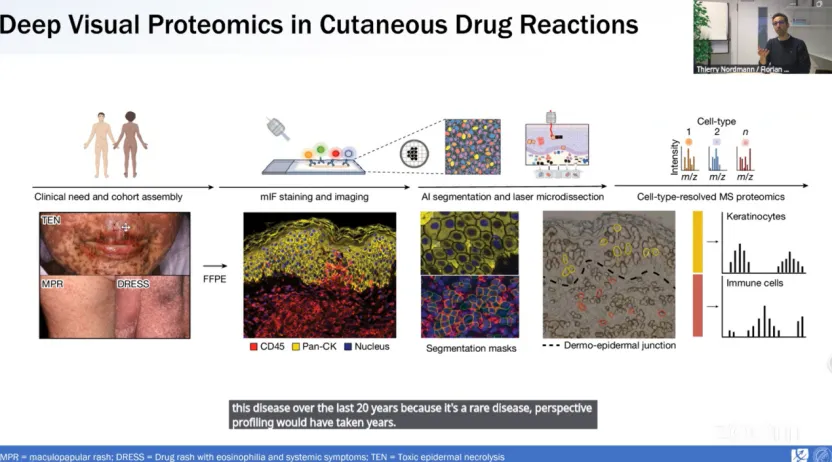
研究使用对患有轻度(MPR)和重度(TEN或DRESS)药物过敏反应患者及健康个体的FFPE皮肤活检样本进行了DVP分析。通过对CD45+免疫细胞和泛角蛋白+角质形成细胞(pan-cytokeratin+ keratinocytes)进行染色,结合机器学习进行细胞分割和激光显微切割,绘制出个体细胞类型特异性的空间蛋白质图谱。
2
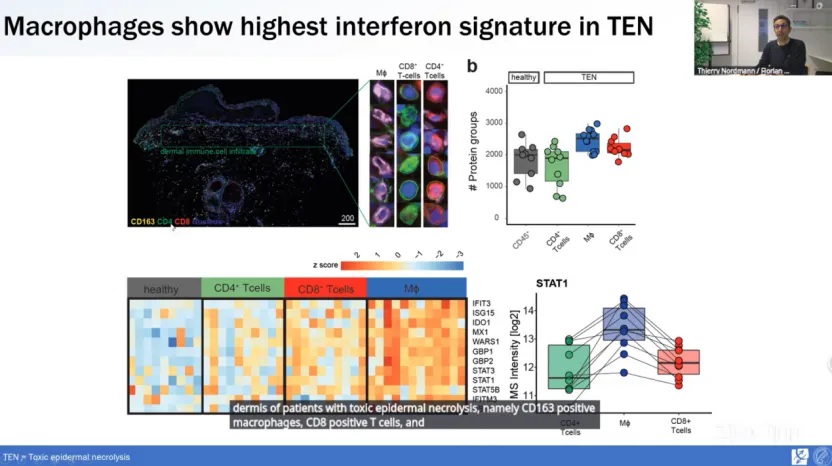
通过多重数据非依赖性采集(mDIA)流程,研究人员分析了TEN患者皮肤中稀少的免疫细胞类型,发现巨噬细胞表现出与干扰素通路相关的最高蛋白质表达,尤其是干扰素信号介导蛋白STAT1在巨噬细胞中的表达显著高于其他免疫细胞。
3
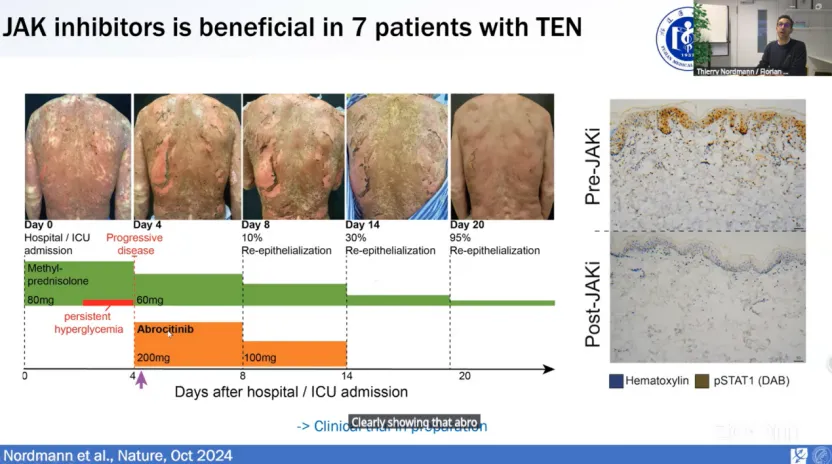
研究团队对7名TEN或SJS-TEN综合征患者进行了JAKi治疗,在使用JAK1抑制剂abrocitinib后,患者的病情在2天内停止恶化,16天后达到95%的皮肤再生,最终完全康复。所有7名患者在治疗后30天内均无副作用,且磷酸化STAT1水平显著降低。这些临床数据显示了JAK1或泛JAK抑制剂在TEN治疗中的潜力。
02
Florian Rosenberger
马克斯·普朗克生物化学研究所 博士后研究员
Decoding Liver Function in Space and Time: Insights from Single-Cell Proteomics
讲座概要:研究通过优化并应用DVP单细胞空间蛋白组学技术,系统解析了α1-抗胰蛋白酶缺乏症(AATD)患者肝组织中因蛋白质错误折叠引发的蛋白毒性反应,揭示了AATD相关蛋白质毒性事件的时序性、过氧化物酶体的保护作用及球形聚集表征晚期肝细胞阶段。
点击观看直播回放片段
精彩瞬间
1
AAT在完整组织中的积累具有明显的空间特征,AAT+和AAT-细胞之间存在清晰的边界。通过单细胞DVP技术,从10μm厚的FFPE切片中分离单个细胞形状,并进行质谱分析,单个细胞单元的蛋白组学深度中位数为2785种蛋白,最多可达4299种蛋白。
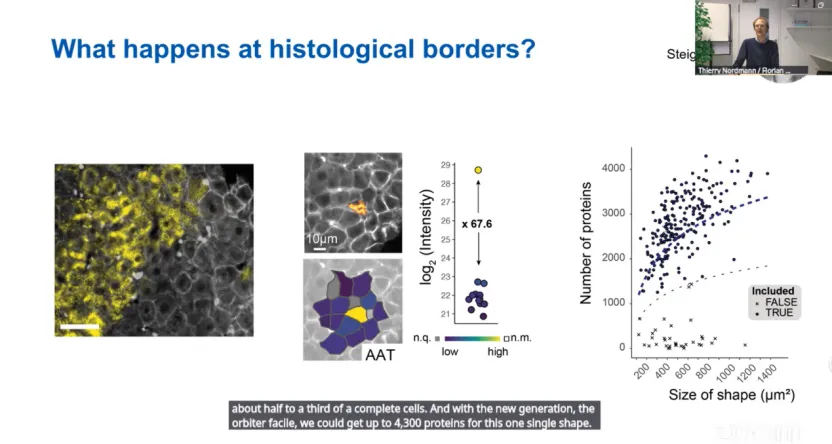
2
在边界区域,早期应答蛋白(如LGALS3BP)高表达,而晚期标志物(如DNAJB11)尚未启动,说明这些区域处于中早期状态。但个别样本中边界细胞表达TNFSF10上调,且伴球状聚集体,提示部分区域可能已过渡到凋亡前状态。
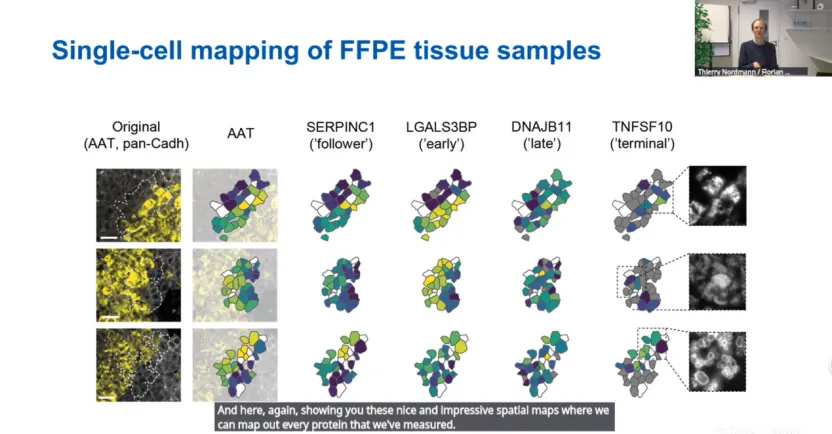
3
研究发现球形聚集细胞中凋亡诱导因子TNFSF10和炎症标记物CRP显著上调,而非球形聚集细胞中与AAT积累相关的标记物(如CES2和ERO1A)表达较高,表明球形聚集可能代表晚期病理状态。将蛋白质组数据映射回组织图像,显示ERO1A和TNFSF10分别富集于非球形和球形聚集细胞群体,进一步证实了两种聚集形态细胞的应答差异。
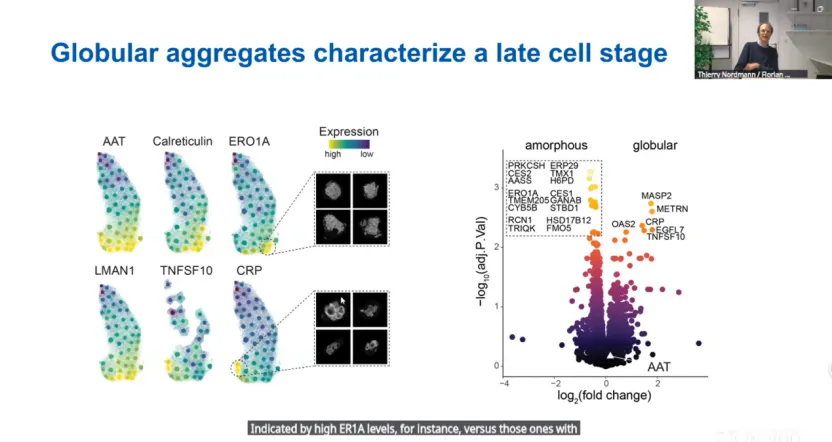
直播期间,观众就两篇空间蛋白质组学研究提出了一些问题,我们收录了部分回复,在此分享给大家:
Q1 在设计研究时,如何在蛋白质组深度、空间分辨率与生物学相关性之间取得平衡?
A1 根据想要解决的生物学问题进行选择。如果研究目的是探究疾病的驱动特征,那么可能不需要深入到单细胞的水平。如果研究目的是探究两个相邻细胞之间的差异,那么就必须深入到单细胞水平。另外,质谱仪的通量也非常重要。理想情况下,我们希望从完整的组织中获得单细胞分辨率的空间蛋白质组,但耗时过长。目前我们使用最先进的液相色谱-质谱平台,通量是每天80个样本,这显然难以覆盖整个组织。因此,我们必须战略性地选择细胞。一种方法是将具有相同生物学特性的细胞组合在一起,这也能让我们获得更大的蛋白质组深度和更多的生物学信息。
Q2 激光显微切割如何确保单细胞的成功收集?
A2 我们使用的激光显微切割系统有多种类型,其中一种采用最终激光脉冲精确地将切割区域推入收集板。虽然在这一过程中没有内置的保障措施能够保证100%的回收率,但我们scDVP实验中得到的数据表明,大约是90%的回收率。
Q3 在DVP工作流程中,激光显微切割技术被用于精确分离细胞,通过激光切割将目标细胞从组织切片中分离出来,以便进行后续的蛋白质组学分析。那么,激光是否会灼烧组织,导致蛋白质鉴定的丢失呢,尤其是对于膜蛋白?
A3 在我们进行的单细胞DVP研究中,特别是肝脏样本,我们发现无论亚细胞定位如何,单细胞与整体样本中的蛋白质表达情况一致。这一结果表明,激光灼烧实际上没有导致后续蛋白鉴定的严重丢失。当然,基于质谱的蛋白质组学,我们只能检测到我们所寻找的蛋白,可能存在我们尚未发现的改变,但基于目前的证据,激光灼烧可能对蛋白质的定量分析影响不大。
Q4 鉴于单细胞蛋白质组学(SCP)和DVP的成本和通量,我们如何推动这些技术的广泛应用?
A4 DVP和scDVP确实是成本较高的技术,但它们所提供的卓越生物学见解有力地证明了其使用价值。例如,scDVP的变异系数(CV值)大约比单细胞转录组学低10倍,意味着我们可以在细胞数量少约100倍的情况下得出统计上稳健的结论。我们正在积极努力提高通量并降低成本,我们期望核心设施和商业举措(例如最近推出的OmicVision,它为外部用户提供DVP服务)扩大这些技术的使用范围。
Q5 我是北京大学药学院的一年级硕士研究生,研究方向是蛋白质组学。我对单细胞空间蛋白质组学非常感兴趣,想问一下Rosenberger博士是否愿意招收来自中国的博士研究生?
A5 很高兴听到你对我们的研究感兴趣!欢迎来自世界各地的热情研究者申请加入我在瑞典斯德哥尔摩的卡罗林斯卡学院的实验室(https://rosenbergerlab.org/),包括国际博士研究生。如果你对潜在的申请机会感兴趣,请随时联系我以获取更多信息。

西湖欧米现已推出FAXP™科研服务及商业化试剂盒,助力广大科研人员高分辨率空间蛋白组学分析,各位老师若感兴趣,欢迎垂询。