研究背景
非小细胞肺癌(NSCLC),长久以来都是全球癌症死亡的主要原因之一。NSCLC虽已通过免疫单药(IO alone)或免疫联合化疗(chemo-IO)改变治疗格局,但一个关键谜题仍未解开:患者的吸烟史究竟如何影响治疗方案选择与最终疗效?
2025年12月21日,由哈佛大学、丹娜-法伯癌症研究所、纪念斯隆凯特琳癌症中心等多机构团队在Journal for Immunotherapy of Cancer上发表了题为“Multi-omics analysis reveals differential benefits of immunotherapy±chemotherapy based on detailed smoking history in advanced non-small cell lung cancer”的研究。该研究对4157例接受免疫单药或免疫联合化疗的晚期NSCLC患者开展大队列分析,整合肿瘤基因组、转录组及血浆蛋白质组等多组学数据,系统探究了吸烟状态与累积吸烟包年数[注1]对治疗结局的差异化影响,为NSCLC个性化治疗选择提供了关键参考。

文章标题
注1:包年数是评估吸烟量与健康风险的重要指标,计算公式为:包年数 = 每日吸烟包数 × 吸烟年数。
实验设计
样本队列:4157例晚期NSCLC患者,按治疗方案分为免疫单药治疗组(IO alone组,n=2768)和免疫联合化疗组(chemo-IO组,n=1389),再根据详细的吸烟史(吸烟状态:从不/既往/当前;吸烟强度:基于累计包年数[注1],分为无、轻度[>0-20包年]、中度[20-40包年]、重度[≥40包年])对患者进行分层分析。
技术方法:整合了肿瘤基因组学、转录组学、血浆蛋白质组学及多重免疫荧光空间表型分析,从基因、转录、蛋白及细胞空间分布多层面,系统刻画肿瘤免疫微环境与系统免疫状态。
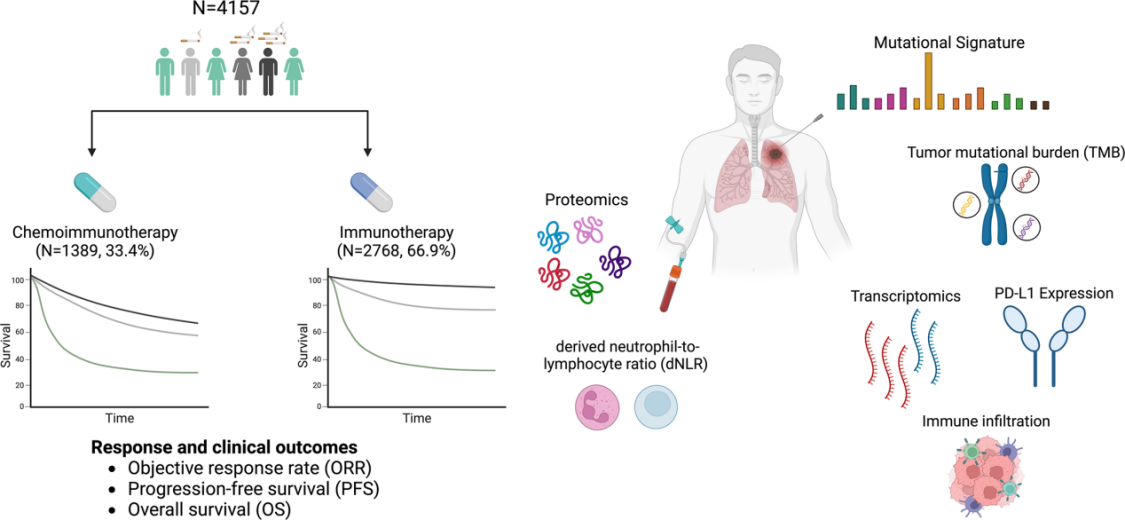
Fig.1 整体实验设计流程
研究结果
1. 吸烟史与免疫单药疗效呈剂量依赖性正相关
研究首先表明,在免疫单药治疗患者中,吸烟状态与强度是决定疗效的独立正向因素。与从不吸烟者相比,当前及既往吸烟者均表现出更优的客观缓解率、无进展生存期与总生存期,且重度吸烟者获益最为显著。疗效随吸烟强度(以累计包年数衡量)呈现阶梯式提升,值得注意的是,这一剂量-效应关系在多变量校正(调整PD-L1 TPS、年龄、性别等混杂因素)后依然稳定(Fig. 2A-F),证实了吸烟史的独立作用。
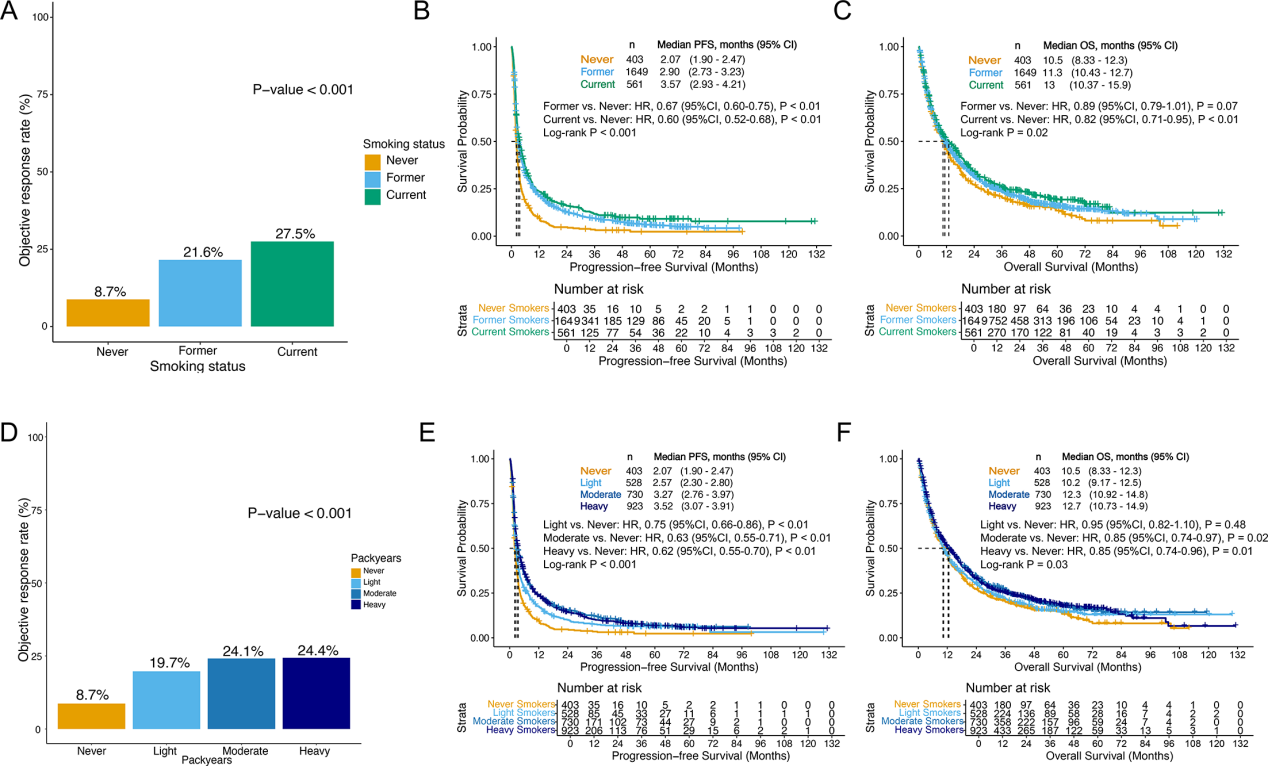
Fig.2 吸烟史与免疫单药疗效呈剂量依赖性正相关
2. 免疫联合化疗中,吸烟史主要带来长期生存获益
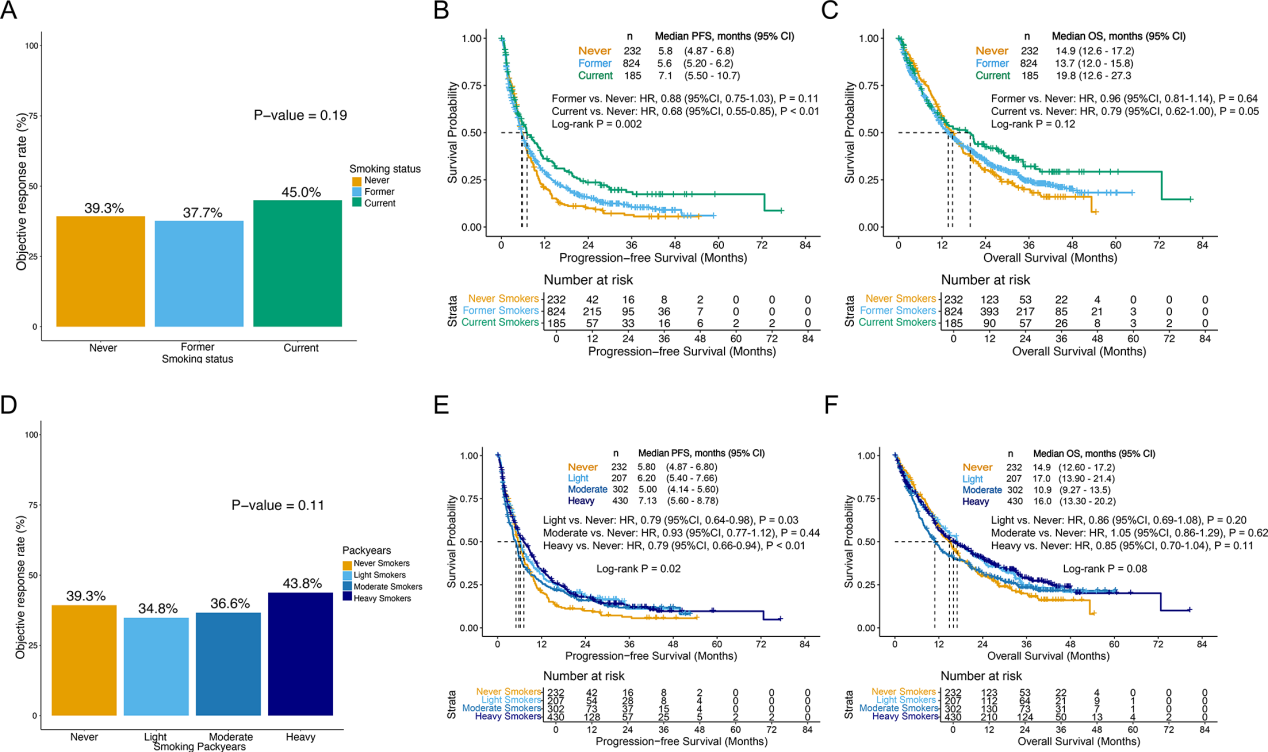
Fig.3 免疫联合化疗中,吸烟史主要带来长期生存获益
3. PD-L1高表达患者吸烟史影响治疗方案疗效差异
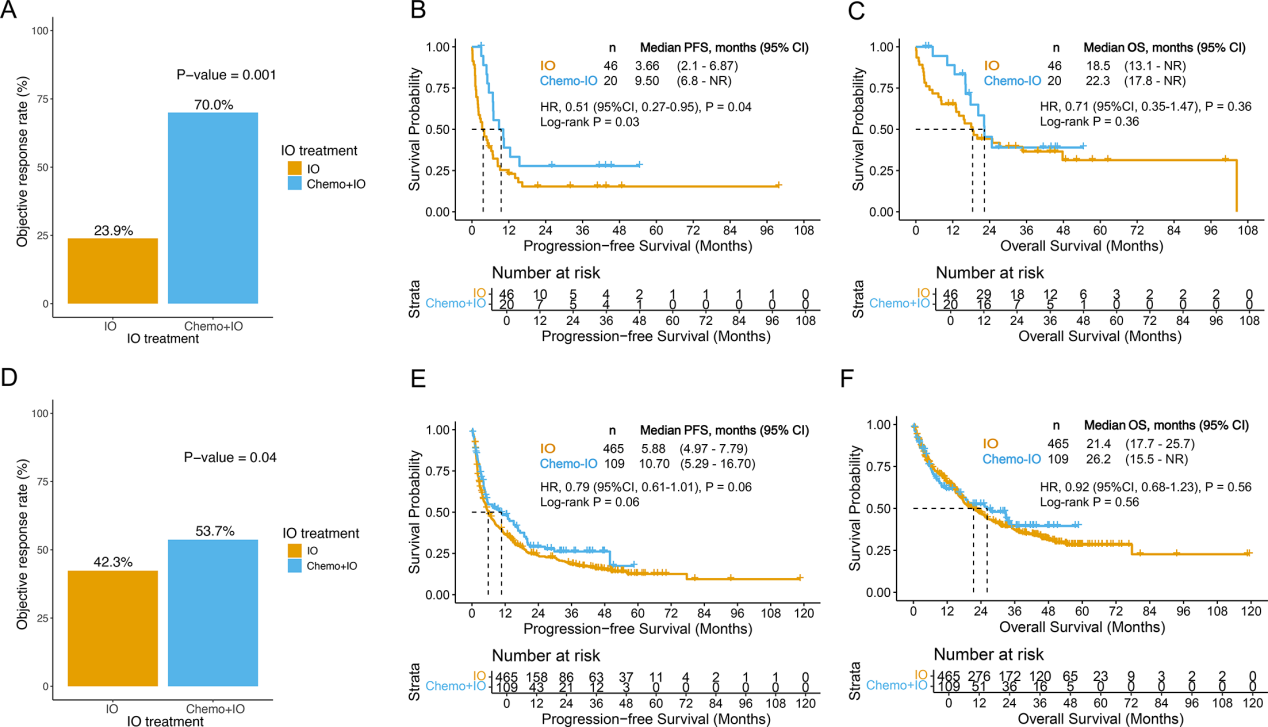
Fig.4 PD-L1高表达患者吸烟史影响治疗方案疗效差异
4. 吸烟相关突变特征可独立预测免疫治疗单药疗效
研究进一步聚焦吸烟相关突变特征(TSMS,核心为COSMIC Signature 4)与免疫单药疗效的关联,结果显示该特征在吸烟者肿瘤中富集,且富集率与吸烟强度正相关(Fig. 5A-B)。更重要的是,TSMS富集能独立预测免疫单药治疗的疗效:富集者的客观缓解率、无进展生存期与总生存期均显著更优(Fig. 5C-E)。即便在调整肿瘤突变负荷后,该预测价值依然成立,为缺乏准确吸烟史记录的患者提供了有效的分子替代指标。
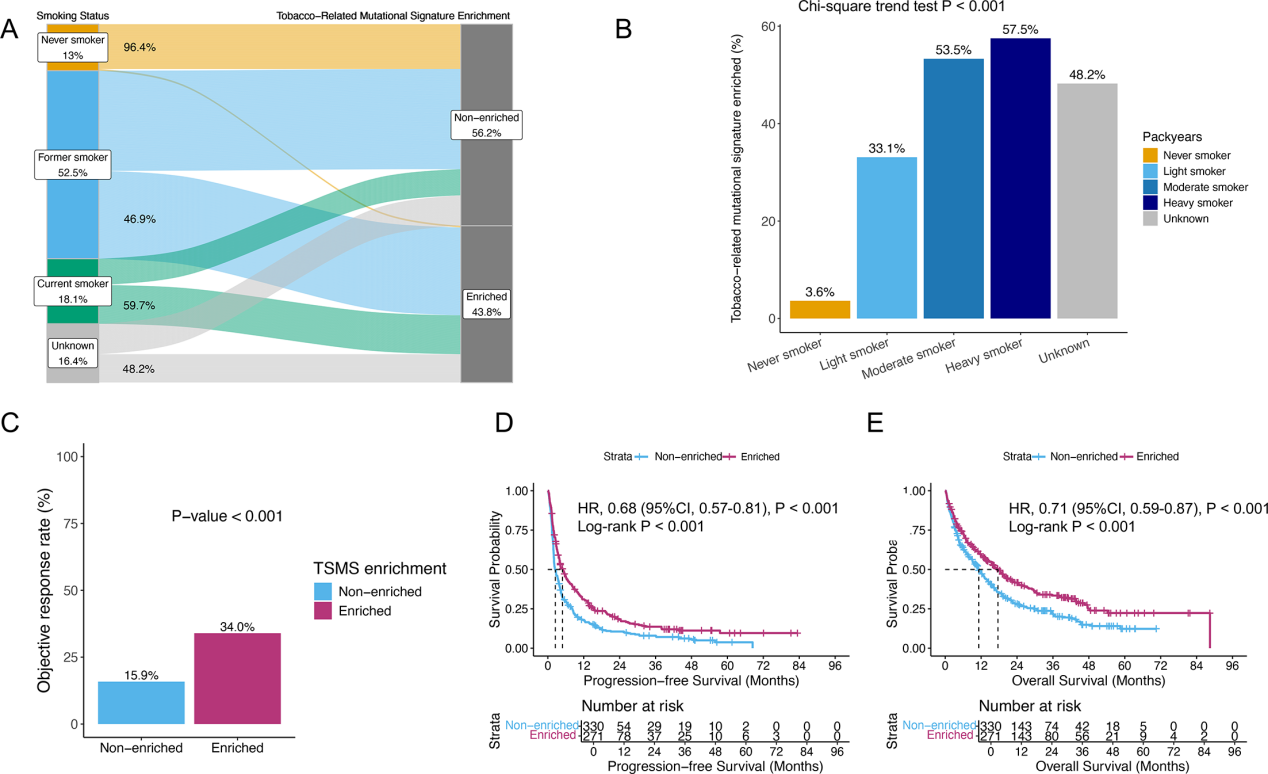
Fig.5 吸烟相关突变特征可独立预测免疫治疗单药疗效
5. 吸烟强度与TMB呈强相关,但与PD-L1及dNLR关联较弱
为探究潜在机制,研究分析了累计吸烟包年数与三项关键生物标志物的关联,结果显示,随着吸烟强度的增加,肿瘤突变负荷(TMB)呈现显著且一致的上升趋势,在重度吸烟者中达到峰值(Fig. 6B),而与PD-L1表达和全身性炎症指标dNLR无显著关联(Fig. 6A, C)。这些发现表明,吸烟主要通过增加肿瘤突变负荷提升免疫原性,非主要通过上调PD-L1或改变基线系统性炎症状态。
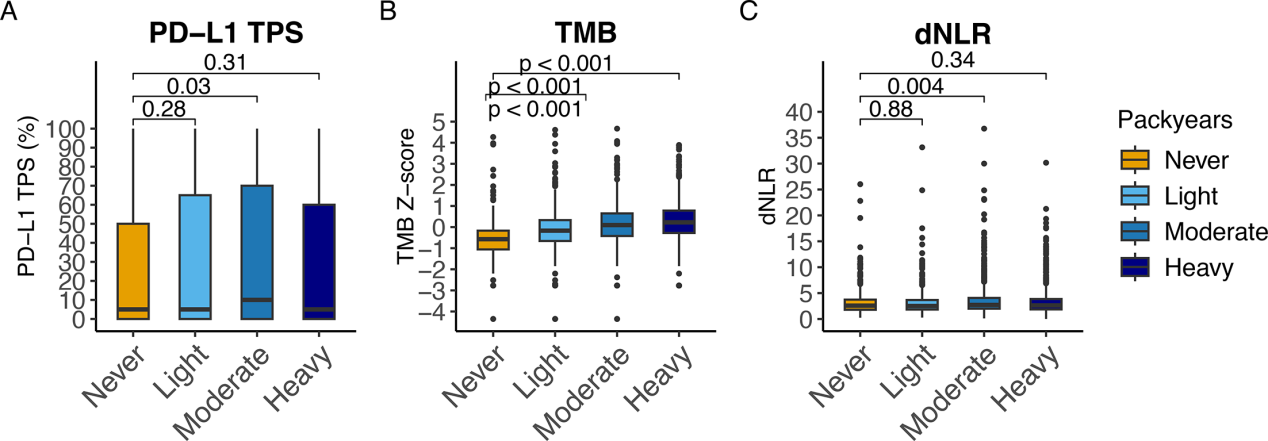
Fig.6 吸烟强度与TMB呈强相关,但与PD-L1及dNLR关联较弱
6. 吸烟重塑肿瘤免疫微环境与系统免疫蛋白谱
最后,研究人员从肿瘤微环境和系统免疫两个层面,分析了吸烟强度与肿瘤免疫浸润及血浆蛋白谱的关联。在肿瘤内,吸烟强度与CD8⁺、PD-1⁺、FOXP3⁺等关键免疫细胞浸润密度正相关(Fig. 7A)。血浆蛋白质组学分析鉴定出CCL7、CXCL17、CDCP1、TNFRSF6B等9个在吸烟者中显著上调的蛋白(Fig. 7B),且其表达水平随吸烟状态(从不、既往、当前)呈梯度变化(Fig. 7C)。这些发现系统阐明了吸烟如何同时塑造免疫活化的肿瘤微环境与外周免疫状态,从而为观察到的疗效差异提供了完整的生物学解释。
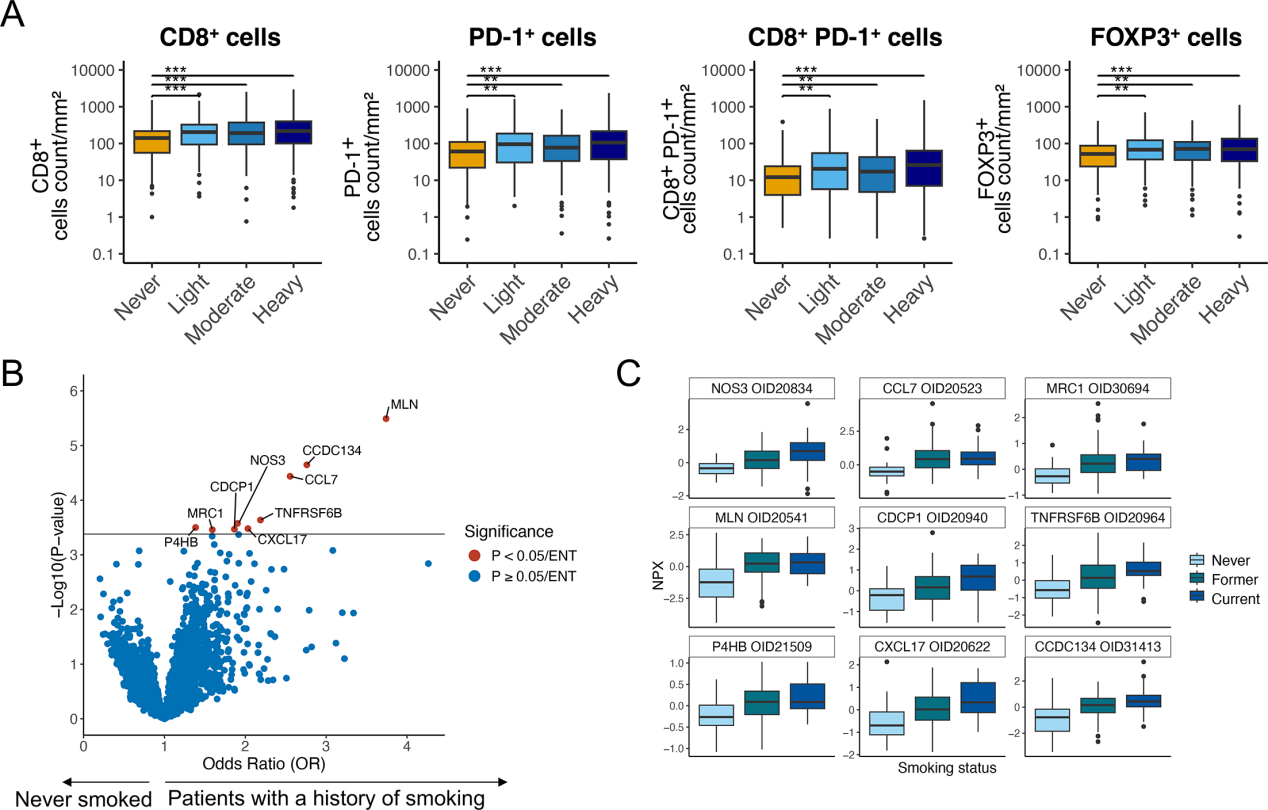
Fig.7 吸烟重塑肿瘤免疫微环境与系统免疫蛋白谱
文章总结
本研究通过多组学分析,揭示了吸烟史对晚期NSCLC免疫治疗疗效的差异化影响及其生物学机制。研究发现:有吸烟史的患者从免疫单药治疗中获益更显著;而无吸烟史的患者在免疫联合化疗中生存结局更优。机制上,吸烟通过诱导烟草相关突变特征、增加肿瘤突变负荷、增强肿瘤内免疫细胞浸润,并重塑外周免疫蛋白谱,从而多维度提升肿瘤免疫原性。结论表明,吸烟史是指导免疫治疗个体化选择的关键临床变量,未来应结合分子标志物优化治疗策略,并为无吸烟史患者探索新的联合治疗方案。
原文链接:https://jitc.bmj.com/content/13/12/e012205
研究背景
非小细胞肺癌(NSCLC),长久以来都是全球癌症死亡的主要原因之一。NSCLC虽已通过免疫单药(IO alone)或免疫联合化疗(chemo-IO)改变治疗格局,但一个关键谜题仍未解开:患者的吸烟史究竟如何影响治疗方案选择与最终疗效?
2025年12月21日,由哈佛大学、丹娜-法伯癌症研究所、纪念斯隆凯特琳癌症中心等多机构团队在Journal for Immunotherapy of Cancer上发表了题为“Multi-omics analysis reveals differential benefits of immunotherapy±chemotherapy based on detailed smoking history in advanced non-small cell lung cancer”的研究。该研究对4157例接受免疫单药或免疫联合化疗的晚期NSCLC患者开展大队列分析,整合肿瘤基因组、转录组及血浆蛋白质组等多组学数据,系统探究了吸烟状态与累积吸烟包年数[注1]对治疗结局的差异化影响,为NSCLC个性化治疗选择提供了关键参考。

文章标题
注1:包年数是评估吸烟量与健康风险的重要指标,计算公式为:包年数 = 每日吸烟包数 × 吸烟年数。
实验设计
样本队列:4157例晚期NSCLC患者,按治疗方案分为免疫单药治疗组(IO alone组,n=2768)和免疫联合化疗组(chemo-IO组,n=1389),再根据详细的吸烟史(吸烟状态:从不/既往/当前;吸烟强度:基于累计包年数[注1],分为无、轻度[>0-20包年]、中度[20-40包年]、重度[≥40包年])对患者进行分层分析。
技术方法:整合了肿瘤基因组学、转录组学、血浆蛋白质组学及多重免疫荧光空间表型分析,从基因、转录、蛋白及细胞空间分布多层面,系统刻画肿瘤免疫微环境与系统免疫状态。

Fig.1 整体实验设计流程
研究结果
1. 吸烟史与免疫单药疗效呈剂量依赖性正相关
研究首先表明,在免疫单药治疗患者中,吸烟状态与强度是决定疗效的独立正向因素。与从不吸烟者相比,当前及既往吸烟者均表现出更优的客观缓解率、无进展生存期与总生存期,且重度吸烟者获益最为显著。疗效随吸烟强度(以累计包年数衡量)呈现阶梯式提升,值得注意的是,这一剂量-效应关系在多变量校正(调整PD-L1 TPS、年龄、性别等混杂因素)后依然稳定(Fig. 2A-F),证实了吸烟史的独立作用。

Fig.2 吸烟史与免疫单药疗效呈剂量依赖性正相关
2. 免疫联合化疗中,吸烟史主要带来长期生存获益

Fig.3 免疫联合化疗中,吸烟史主要带来长期生存获益
3. PD-L1高表达患者吸烟史影响治疗方案疗效差异

Fig.4 PD-L1高表达患者吸烟史影响治疗方案疗效差异
4. 吸烟相关突变特征可独立预测免疫治疗单药疗效
研究进一步聚焦吸烟相关突变特征(TSMS,核心为COSMIC Signature 4)与免疫单药疗效的关联,结果显示该特征在吸烟者肿瘤中富集,且富集率与吸烟强度正相关(Fig. 5A-B)。更重要的是,TSMS富集能独立预测免疫单药治疗的疗效:富集者的客观缓解率、无进展生存期与总生存期均显著更优(Fig. 5C-E)。即便在调整肿瘤突变负荷后,该预测价值依然成立,为缺乏准确吸烟史记录的患者提供了有效的分子替代指标。

Fig.5 吸烟相关突变特征可独立预测免疫治疗单药疗效
5. 吸烟强度与TMB呈强相关,但与PD-L1及dNLR关联较弱
为探究潜在机制,研究分析了累计吸烟包年数与三项关键生物标志物的关联,结果显示,随着吸烟强度的增加,肿瘤突变负荷(TMB)呈现显著且一致的上升趋势,在重度吸烟者中达到峰值(Fig. 6B),而与PD-L1表达和全身性炎症指标dNLR无显著关联(Fig. 6A, C)。这些发现表明,吸烟主要通过增加肿瘤突变负荷提升免疫原性,非主要通过上调PD-L1或改变基线系统性炎症状态。

Fig.6 吸烟强度与TMB呈强相关,但与PD-L1及dNLR关联较弱
6. 吸烟重塑肿瘤免疫微环境与系统免疫蛋白谱
最后,研究人员从肿瘤微环境和系统免疫两个层面,分析了吸烟强度与肿瘤免疫浸润及血浆蛋白谱的关联。在肿瘤内,吸烟强度与CD8⁺、PD-1⁺、FOXP3⁺等关键免疫细胞浸润密度正相关(Fig. 7A)。血浆蛋白质组学分析鉴定出CCL7、CXCL17、CDCP1、TNFRSF6B等9个在吸烟者中显著上调的蛋白(Fig. 7B),且其表达水平随吸烟状态(从不、既往、当前)呈梯度变化(Fig. 7C)。这些发现系统阐明了吸烟如何同时塑造免疫活化的肿瘤微环境与外周免疫状态,从而为观察到的疗效差异提供了完整的生物学解释。

Fig.7 吸烟重塑肿瘤免疫微环境与系统免疫蛋白谱
文章总结
本研究通过多组学分析,揭示了吸烟史对晚期NSCLC免疫治疗疗效的差异化影响及其生物学机制。研究发现:有吸烟史的患者从免疫单药治疗中获益更显著;而无吸烟史的患者在免疫联合化疗中生存结局更优。机制上,吸烟通过诱导烟草相关突变特征、增加肿瘤突变负荷、增强肿瘤内免疫细胞浸润,并重塑外周免疫蛋白谱,从而多维度提升肿瘤免疫原性。结论表明,吸烟史是指导免疫治疗个体化选择的关键临床变量,未来应结合分子标志物优化治疗策略,并为无吸烟史患者探索新的联合治疗方案。
原文链接:https://jitc.bmj.com/content/13/12/e012205