♦ 研究背景及简介
2025年10月30日,广州医科大学附属第三医院消化内科李明松主任团队于 eBioMedicine 上发表文章《Significance of integrated clinical and proteomic characteristics analysis for pathogenesis and management of Crohn’s disease with concomitant psoriasis》。研究聚焦于克罗恩病(Crohn's disease, CD)合并银屑病(psoriasis, PS)这一临床罕见且治疗棘手的共病状态(CDPS),两者同为免疫介导疾病,共享易感基因和免疫通路,但CDPS的发病机制、预后评估及治疗策略长期缺乏系统性研究。
本文通过多层次蛋白组学和动物验证等方法,系统性的揭示了CDPS的潜在机制并通过构建组学标志物模型为疾病的发生风险和治疗获益提供指导。西湖欧米为该研究提供了蛋白质组和宏蛋白质组检测服务。
♦ 实验样本和组学实验设计
肠黏膜蛋白质组:取CDPS(克罗恩病合并银屑病)、CD(克罗恩病)、HC(健康对照)结肠镜活检FFPE样本(HC=6、CD=10、CDPS=8)
体液蛋白质组:血清、尿液(血清:HC=10、CD=10、CDPS=9;尿液:HC=10、CD=10、CDPS=5)
粪便宏蛋白质组:粪便样本(HC=7、CD=7、CDPS=7)
♦ 主要结果
1. 研究结果展示了总体实验设计和肠黏膜蛋白组学概况,并指出CDPS关键差异通路:白细胞介导的免疫反应、角质形成、内质网(ER)应激等通路礠可显著上调;TCA循环、脂肪酸B氧化、支链氨基酸代谢等通路则显著下调(Fig.1 F,G,I)。

Fig.1 蛋白组学结果展示
2. 肠黏膜蛋白组学通过WGCNA分析进一步发现和疾病相关的蛋白模块:蓝、青模块与CDPS发生正相关,棕模块负相关(Fig.2 C),并对相关模块进行富集分析,进一步聚焦到了免疫、角质化和能量代谢等方向(Fig.2 E)。
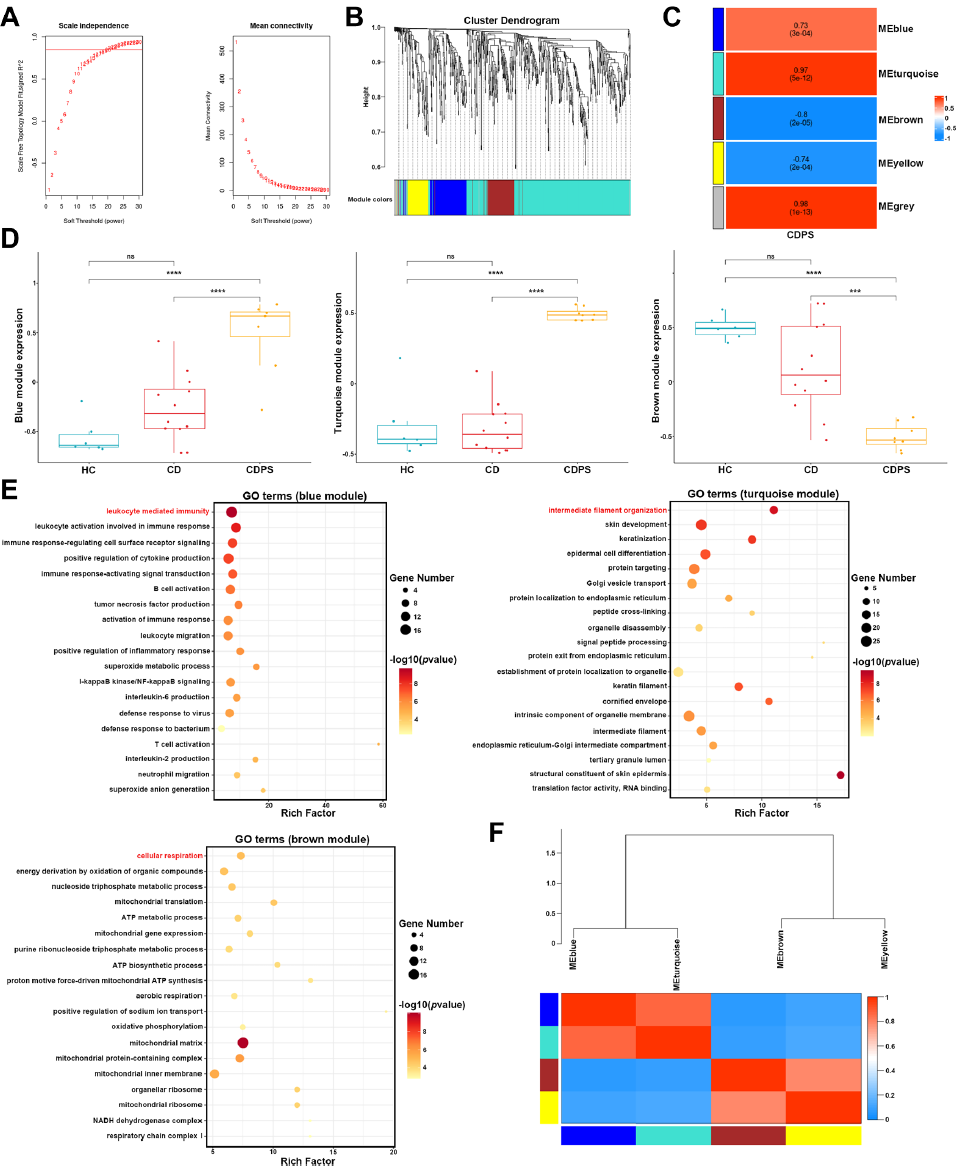
Fig.2 WGCNA分析空间蛋白质组学
3. 核心模块指标分析和验证,展示了KRT7的蛋白互作网络,发现其与TNF家族存在密切联系,进一步进行了临床mIHC验证,证实了KRT7与TNF存在共定位,解释了潜在免疫调控可能。
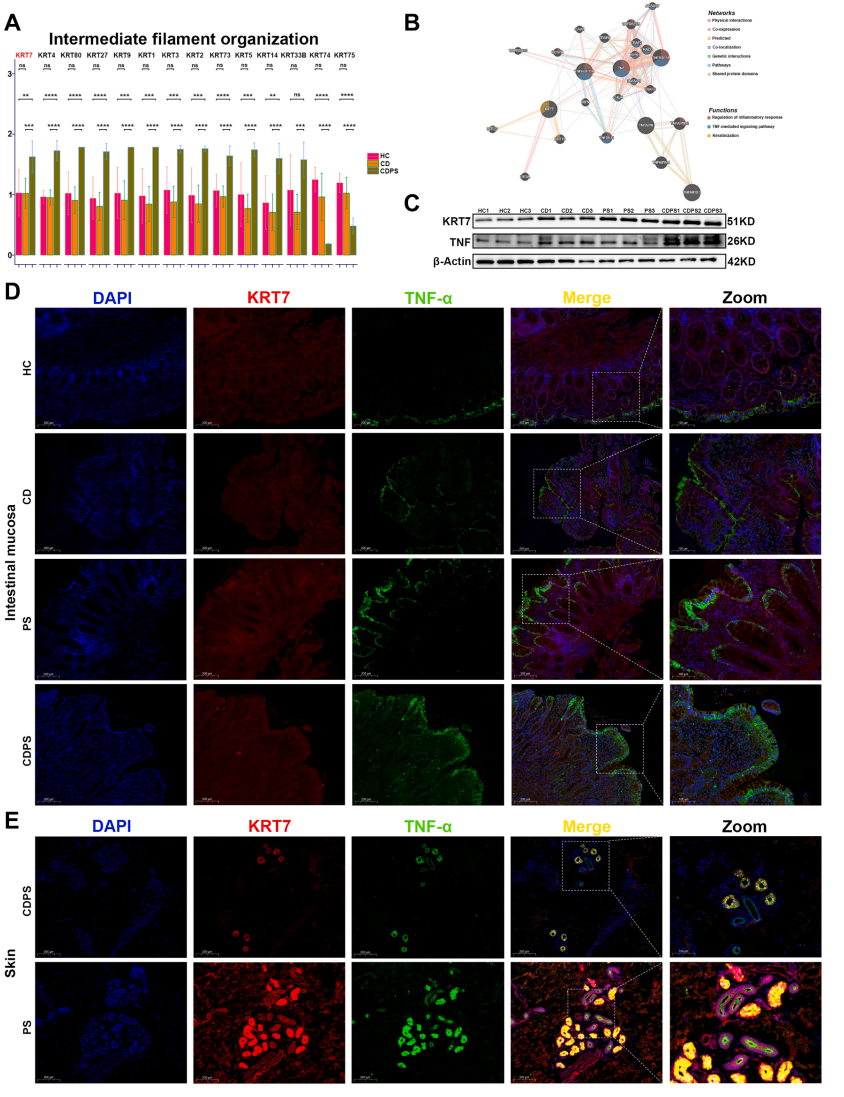
Fig.3 深入分析和验证
4. 体液(血清、尿液)蛋白组学显著差异的交集为下调蛋白HGFAC(Fig.4 C),HGFAC是丝氨酸内肽酶、肝细胞生长因子的前体激活节点,连接脂质代谢与免疫,揭示其疾病的关键调控作用。
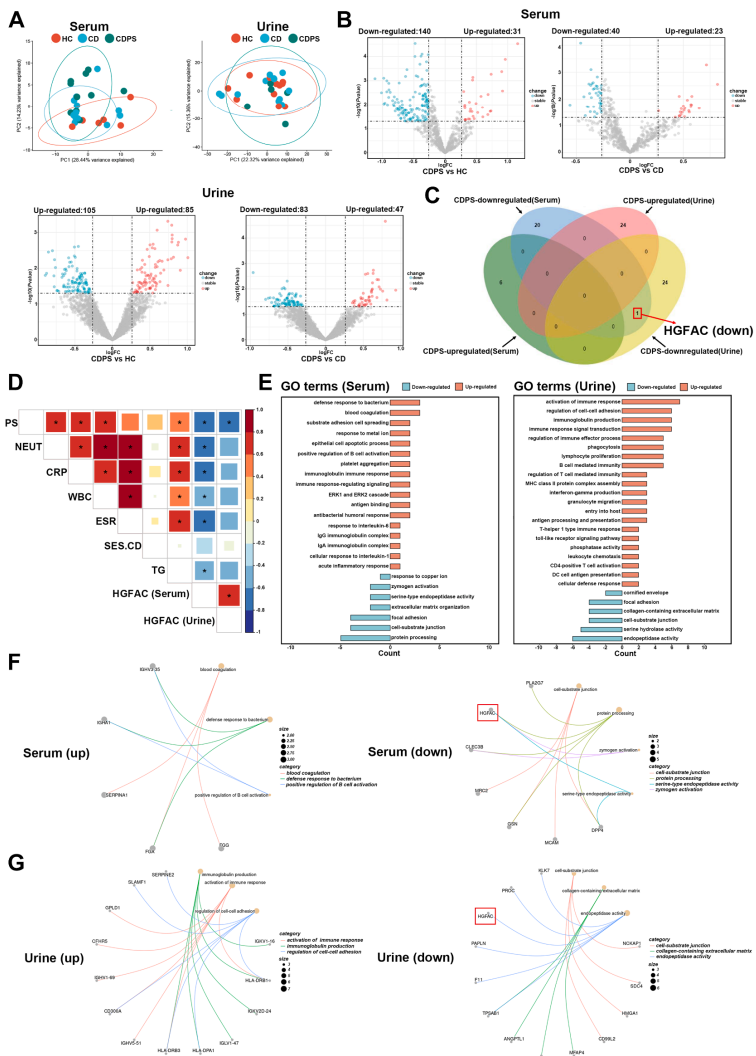
Fig.4 体液蛋白组
5. 粪便宏蛋白组学揭示了肠道微生物的变化扰动,通过LASSO分析进一步挖掘出了M.micronuciformis等关键微生物与CDPS患者脂质代谢减少相关(Fig.5 F),而这些微生物的COG,KO等功能注释显示其与脂质转运和代谢相关,所以这类微生物的减少可能导致脂质的累积。肠粘膜的油红染色结果也证实了上述观点:即与CD组和HC组相比,CDPS患者有显著的脂质积累(Fig.5 G)。
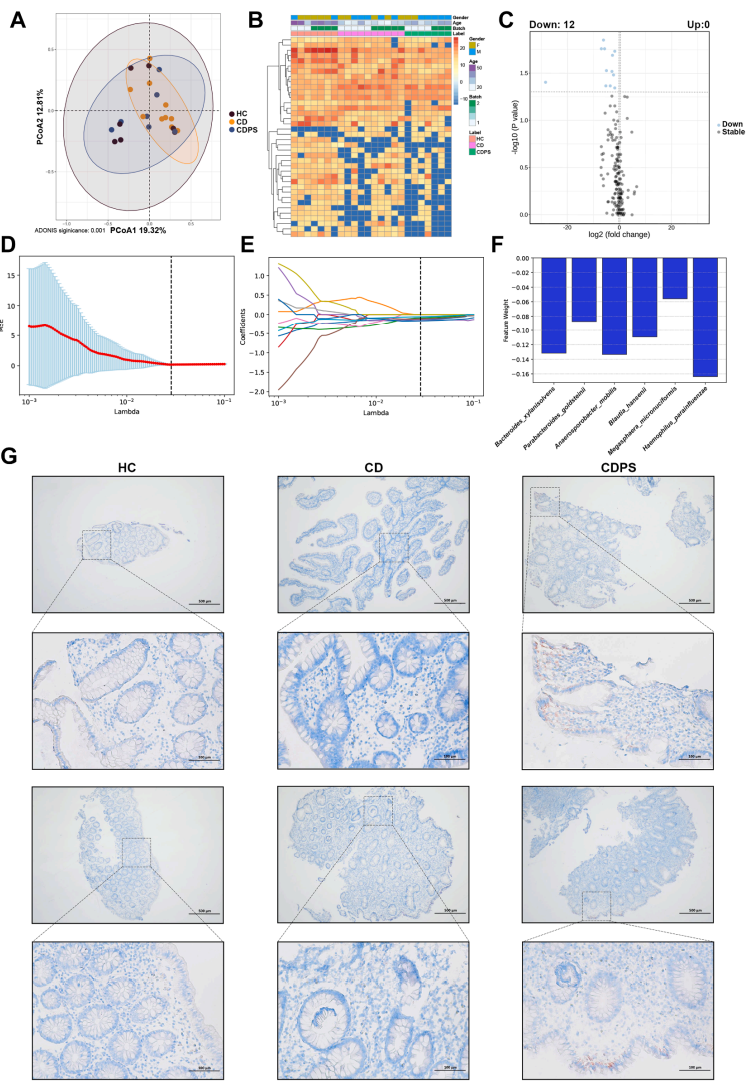
Fig.5 粪便宏蛋白组
6. CDPS 预测以及蛋白质组学与临床特征相关性,WGCNA模块与临床关联分析、免疫浸润分析等深入探讨了疾病和免疫等关系,并构建了3种诊断模型(Fig.6 F-H):肠黏膜模型(青色模块+活化CD8+T)AUC=0.83;体液模型(血清/尿HGFAC)AUC=0.83;CDPS风险模型(青色模块+KRT7+血清HGFAC)AUC=0.83,为该疾病的诊断和预后风险评价提供了参考工具。
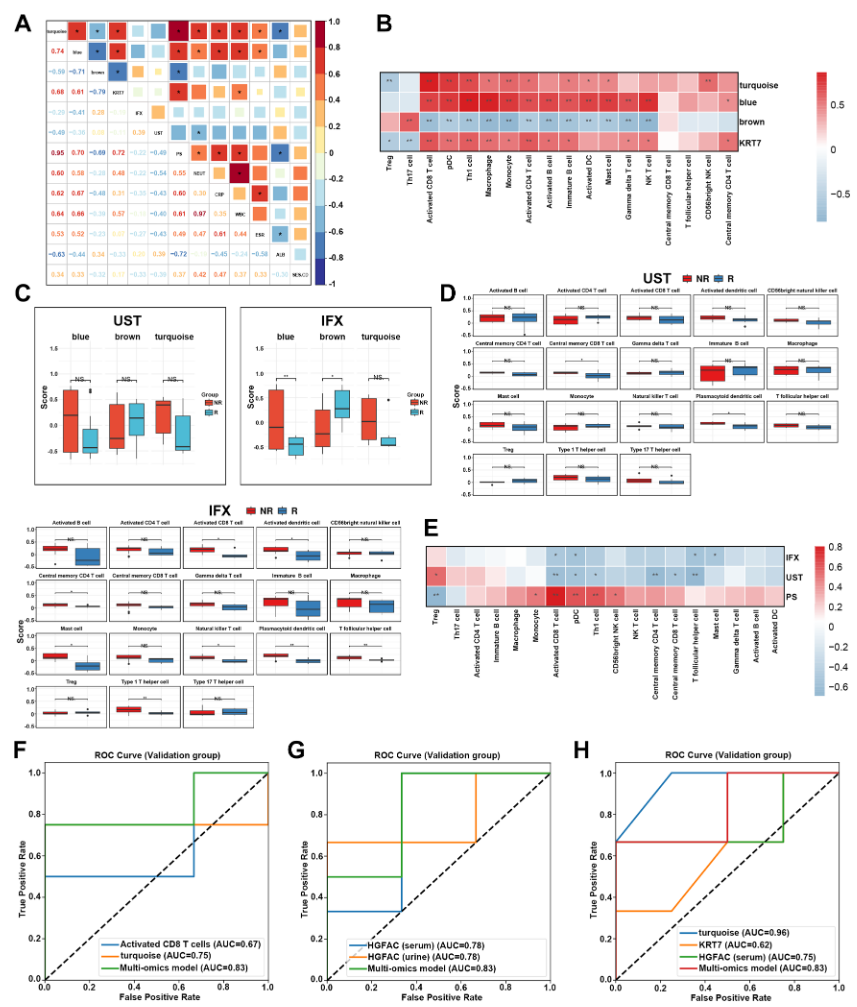
Fig.6 CDPS的预测以及蛋白质组学与临床特征的相关性
7. 动物实验进一步论证了HGFAC、KRT7和M.micronuciformis与CDPS的发病和进展关系,与对照组相比,基因干预组与菌群处理组动物均表现出明显的疾病表型变化。
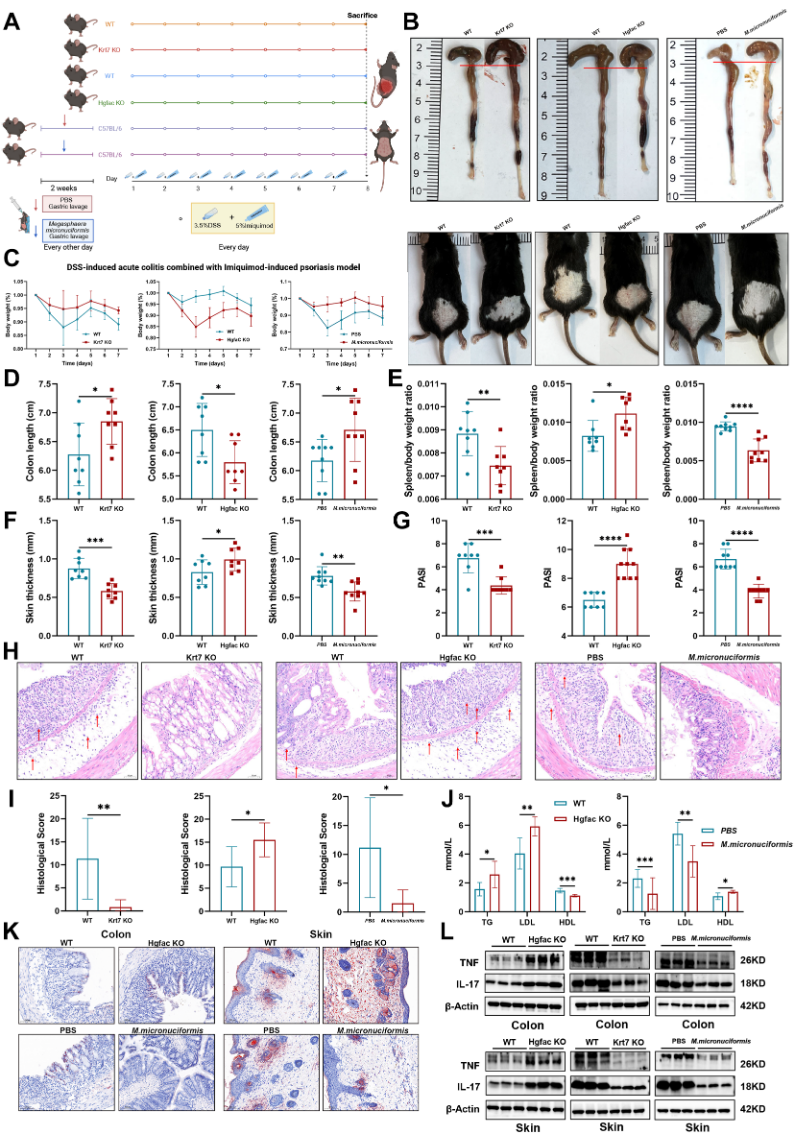
Fig.7 动物模型验证
小结:文章系统梳理了克罗恩合并银屑病CDPS的机制链路,HGFAC缺失与KRT7过表达分别通过“脂质-免疫”与“角质-炎症”轴,双向放大肠-皮共炎症反应,而补充脂质代谢相关微生物M.micronuciformis或可成为有用的治疗手段。

♦ 研究背景及简介
2025年10月30日,广州医科大学附属第三医院消化内科李明松主任团队于 eBioMedicine 上发表文章《Significance of integrated clinical and proteomic characteristics analysis for pathogenesis and management of Crohn’s disease with concomitant psoriasis》。研究聚焦于克罗恩病(Crohn's disease, CD)合并银屑病(psoriasis, PS)这一临床罕见且治疗棘手的共病状态(CDPS),两者同为免疫介导疾病,共享易感基因和免疫通路,但CDPS的发病机制、预后评估及治疗策略长期缺乏系统性研究。
本文通过多层次蛋白组学和动物验证等方法,系统性的揭示了CDPS的潜在机制并通过构建组学标志物模型为疾病的发生风险和治疗获益提供指导。西湖欧米为该研究提供了蛋白质组和宏蛋白质组检测服务。
♦ 实验样本和组学实验设计
肠黏膜蛋白质组:取CDPS(克罗恩病合并银屑病)、CD(克罗恩病)、HC(健康对照)结肠镜活检FFPE样本(HC=6、CD=10、CDPS=8)
体液蛋白质组:血清、尿液(血清:HC=10、CD=10、CDPS=9;尿液:HC=10、CD=10、CDPS=5)
粪便宏蛋白质组:粪便样本(HC=7、CD=7、CDPS=7)
♦ 主要结果
1. 研究结果展示了总体实验设计和肠黏膜蛋白组学概况,并指出CDPS关键差异通路:白细胞介导的免疫反应、角质形成、内质网(ER)应激等通路礠可显著上调;TCA循环、脂肪酸B氧化、支链氨基酸代谢等通路则显著下调(Fig.1 F,G,I)。

Fig.1 蛋白组学结果展示
2. 肠黏膜蛋白组学通过WGCNA分析进一步发现和疾病相关的蛋白模块:蓝、青模块与CDPS发生正相关,棕模块负相关(Fig.2 C),并对相关模块进行富集分析,进一步聚焦到了免疫、角质化和能量代谢等方向(Fig.2 E)。

Fig.2 WGCNA分析空间蛋白质组学
3. 核心模块指标分析和验证,展示了KRT7的蛋白互作网络,发现其与TNF家族存在密切联系,进一步进行了临床mIHC验证,证实了KRT7与TNF存在共定位,解释了潜在免疫调控可能。

Fig.3 深入分析和验证
4. 体液(血清、尿液)蛋白组学显著差异的交集为下调蛋白HGFAC(Fig.4 C),HGFAC是丝氨酸内肽酶、肝细胞生长因子的前体激活节点,连接脂质代谢与免疫,揭示其疾病的关键调控作用。

Fig.4 体液蛋白组
5. 粪便宏蛋白组学揭示了肠道微生物的变化扰动,通过LASSO分析进一步挖掘出了M.micronuciformis等关键微生物与CDPS患者脂质代谢减少相关(Fig.5 F),而这些微生物的COG,KO等功能注释显示其与脂质转运和代谢相关,所以这类微生物的减少可能导致脂质的累积。肠粘膜的油红染色结果也证实了上述观点:即与CD组和HC组相比,CDPS患者有显著的脂质积累(Fig.5 G)。

Fig.5 粪便宏蛋白组
6. CDPS 预测以及蛋白质组学与临床特征相关性,WGCNA模块与临床关联分析、免疫浸润分析等深入探讨了疾病和免疫等关系,并构建了3种诊断模型(Fig.6 F-H):肠黏膜模型(青色模块+活化CD8+T)AUC=0.83;体液模型(血清/尿HGFAC)AUC=0.83;CDPS风险模型(青色模块+KRT7+血清HGFAC)AUC=0.83,为该疾病的诊断和预后风险评价提供了参考工具。

Fig.6 CDPS的预测以及蛋白质组学与临床特征的相关性
7. 动物实验进一步论证了HGFAC、KRT7和M.micronuciformis与CDPS的发病和进展关系,与对照组相比,基因干预组与菌群处理组动物均表现出明显的疾病表型变化。

Fig.7 动物模型验证
小结:文章系统梳理了克罗恩合并银屑病CDPS的机制链路,HGFAC缺失与KRT7过表达分别通过“脂质-免疫”与“角质-炎症”轴,双向放大肠-皮共炎症反应,而补充脂质代谢相关微生物M.micronuciformis或可成为有用的治疗手段。