文章标题
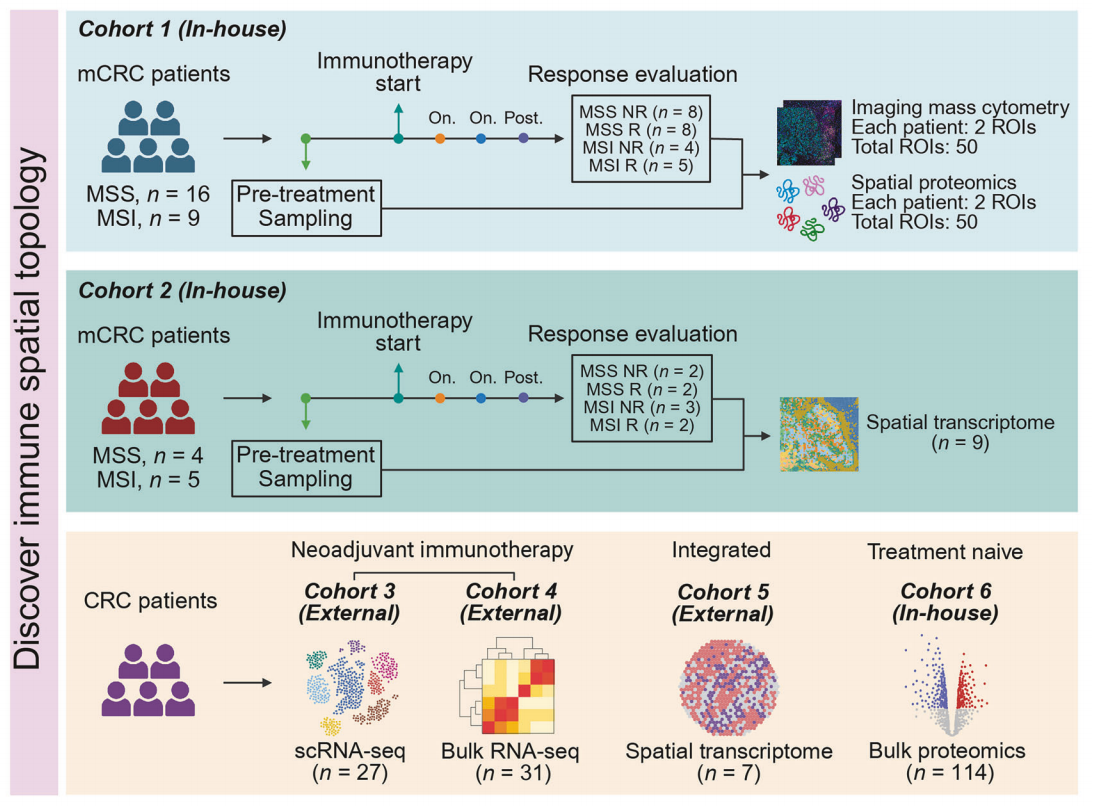
图1 研究概述
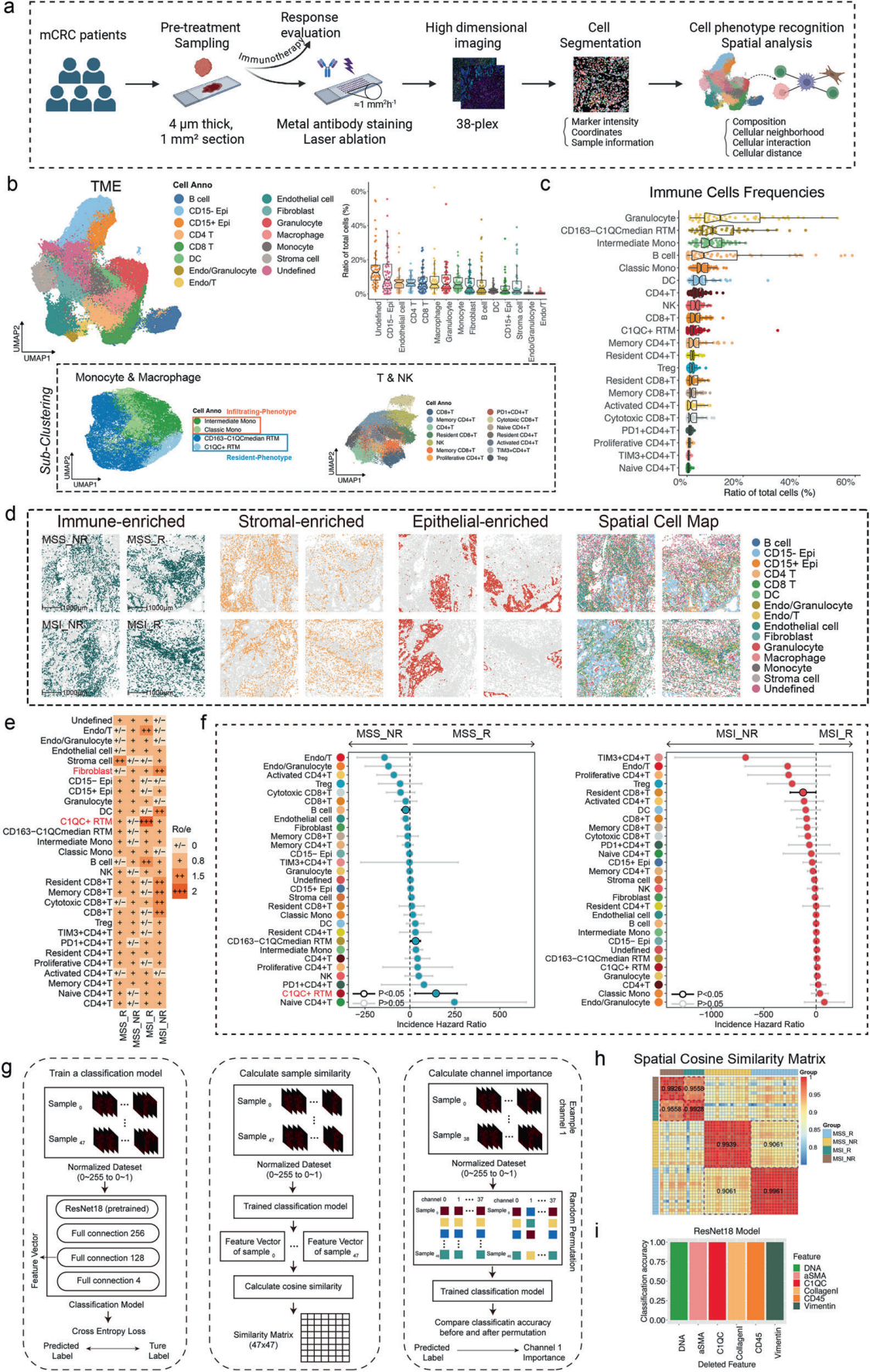
Figure 2 结直细胞癌患者MSS/MSI_R和NR的单细胞分辨率空间免疫表型
结论2:空间拓扑分析揭示功能性细胞生态位与物理屏障
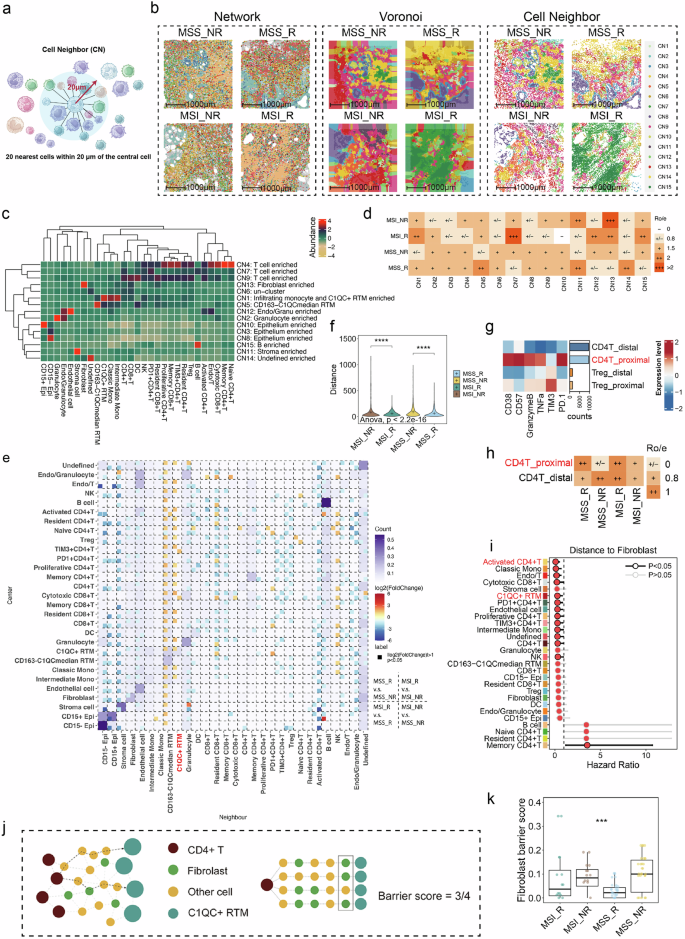
Figure 3 结直肠癌患者MSS/MSI_R和NR的空间细胞邻近关系及细胞间距离表型分析
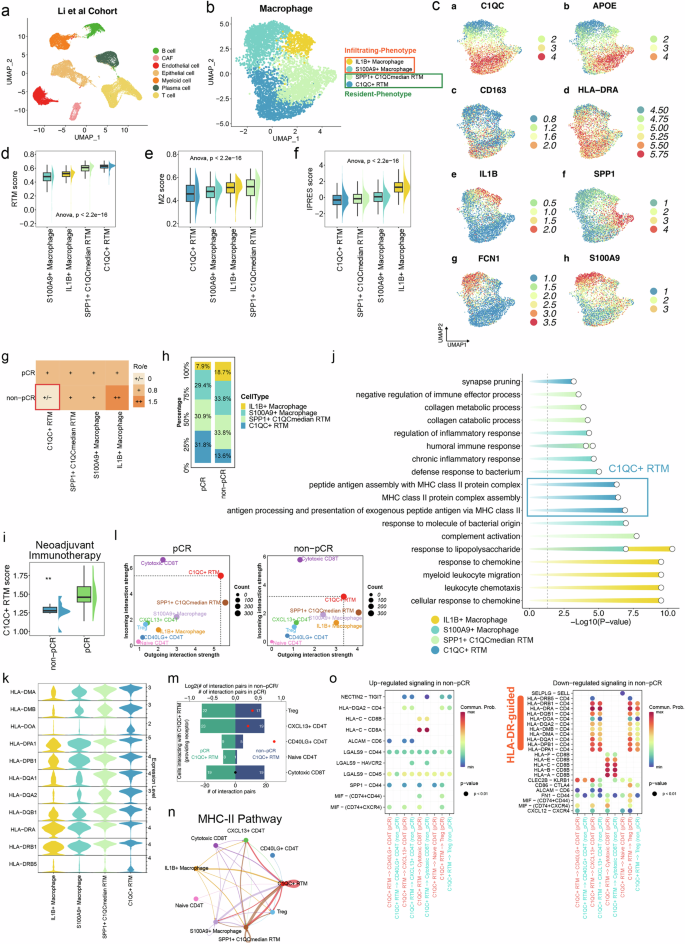
Figure 4 C1QC+ RTM通过MHC II类信号通路介导免疫激活
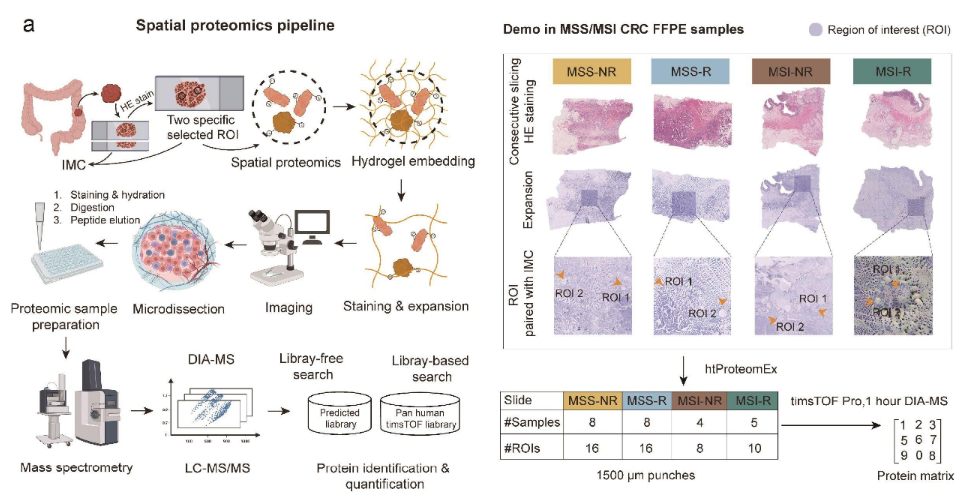
Figure S20 FAXP™工作流程图
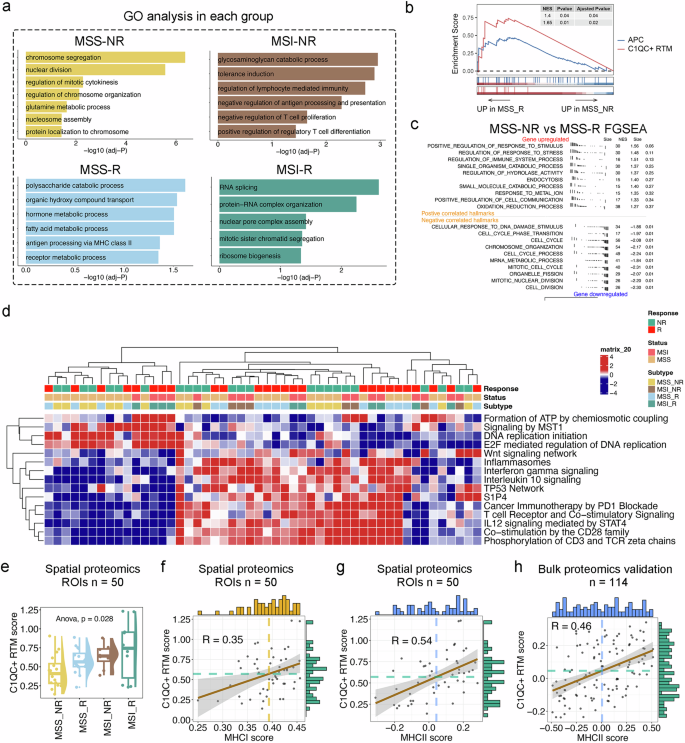
Figure 5 配对空间分辨率蛋白质组学证实,C1QC+常驻组织巨噬细胞在免疫治疗中发挥抗原呈递作用
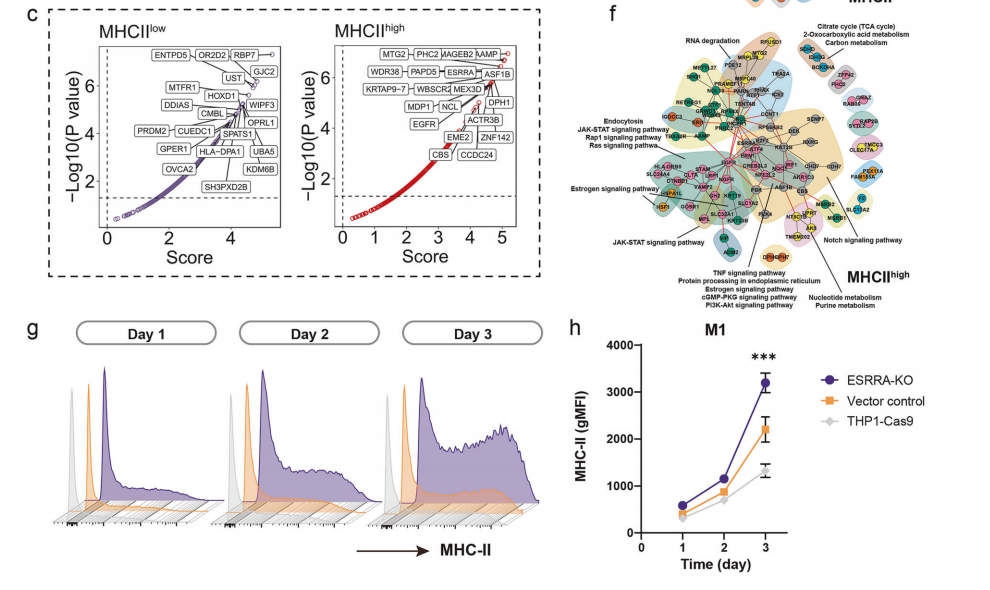
Figure 6 全基因组筛选检测发现C1QC+常驻组织巨噬细胞中存在调控抗原呈递细胞功能的潜在相关通路

文章标题

图1 研究概述

Figure 2 结直细胞癌患者MSS/MSI_R和NR的单细胞分辨率空间免疫表型
结论2:空间拓扑分析揭示功能性细胞生态位与物理屏障

Figure 3 结直肠癌患者MSS/MSI_R和NR的空间细胞邻近关系及细胞间距离表型分析

Figure 4 C1QC+ RTM通过MHC II类信号通路介导免疫激活

Figure S20 FAXP™工作流程图

Figure 5 配对空间分辨率蛋白质组学证实,C1QC+常驻组织巨噬细胞在免疫治疗中发挥抗原呈递作用

Figure 6 全基因组筛选检测发现C1QC+常驻组织巨噬细胞中存在调控抗原呈递细胞功能的潜在相关通路