01 (NAT MED) 多发性硬化症中髓鞘损伤先于轴突损伤和症状发作
02 (CIRCULATION) 肥厚型心肌病中超收缩性和氧化应激驱动肌酸激酶功能障碍
03 (NAT BIOTECHNOL) AlphaDIA 实现非依赖性迁移学习用于无特征蛋白质组学
04 (NAT GENET) 多模态空间表征肿瘤免疫微环境识别弥漫大B细胞淋巴瘤中的可靶向炎症生态位
05 (J EXTRACELL VESICLES) 来源于间充质干细胞和星形胶质细胞的混合细胞外囊泡用于靶向神经退行性疾病应用

1. (Nature Medicine,IF:58.7) 多发性硬化症中髓鞘损伤先于轴突损伤和症状发作
原文链接: https://www.nature.com/articles/s41591-025-04014-w

2. (Circulation,IF:35.5) 肥厚型心肌病中超收缩性和氧化应激驱动肌酸激酶功能障碍

3. (Nature Biotechnology,IF:33.1) AlphaDIA 实现非依赖性迁移学习用于无特征蛋白质组学

4. (Nature Genetics,IF:31.7) 多模态空间表征肿瘤免疫微环境识别弥漫大B细胞淋巴瘤中的可靶向炎症生态位

5. (Journal of Extracellular Vesicles,IF:15.5) 来源于间充质干细胞和星形胶质细胞的混合细胞外囊泡用于靶向神经退行性疾病应用
加州大学戴维斯分校的 David Wang 团队在《Journal of Extracellular Vesicles》上发表的研究,通过膜融合技术,将间充质干细胞衍生的 EVs 与星形胶质细胞衍生的 EVs 结合,生成了一种新型混合 EV 制剂。这种混合 EV 制剂在神经退行性疾病治疗中具有潜力。
研究利用超分辨率显微镜和定量蛋白质组学分析,对混合 EV 制剂进行了表征和优化,发现其具有脑细胞靶向、神经保护和免疫调节能力,为神经退行性疾病的治疗提供了新思路。
该研究为神经退行性疾病的治疗提供了新的策略和工具,混合 EV 制剂的开发有望突破传统治疗方法的局限,为患者带来更有效的治疗选择,改善神经退行性疾病患者的预后。
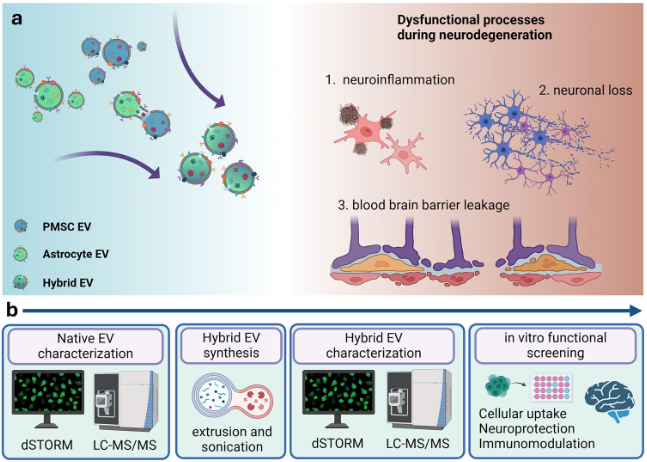
研究概览

6. (Nature Communications,IF:14.7) 可扩展近端蛋白质组学的最佳诱饵集计算设计与评估
该研究为近端蛋白质组学技术的发展提供了新的方法和思路,有助于提高蛋白质组学研究的效率和准确性,推动相关领域的研究进展,为生物医学研究提供更有力的技术支持。
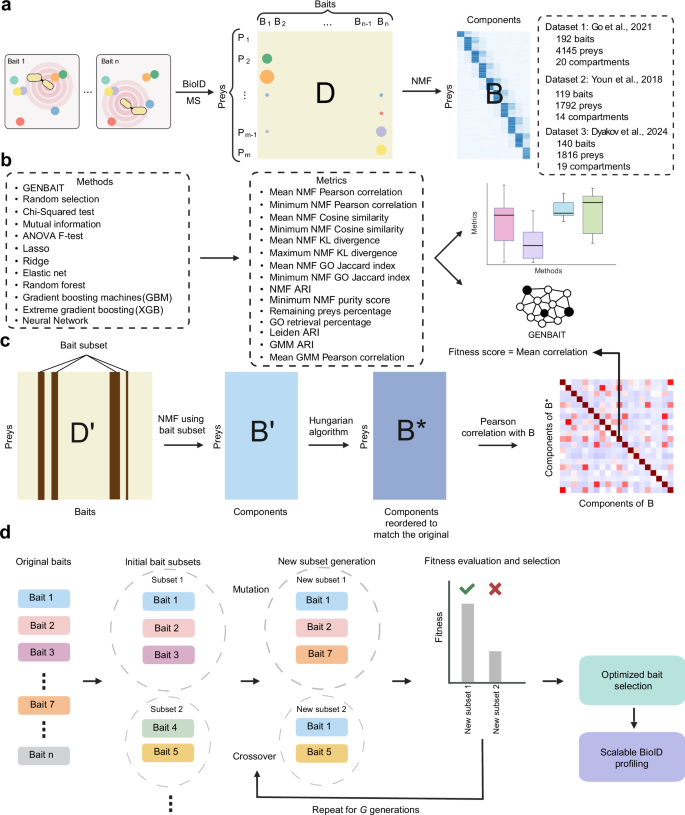
GENBAIT 工作流程与评估

7. (Nature Communications,IF:14.7) 冷冻电子断层扫描可视化溶酶体膜蛋白

TRPML1-mNeonGreen-1D4 和 TMEM192-mCherry-1D4 阳性溶酶体的验证

8. (Autophagy,IF:14.6) Entrectinib 通过抑制 OTUD5-MTORC1 信号通路结合 HMGB1 激活心肌细胞自噬诱导心脏毒性
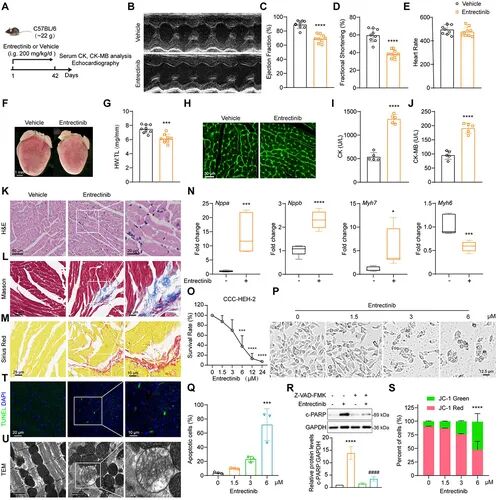
图示:Entrectinib(恩曲替尼)可诱导心肌损伤和左心室功能障碍
01 (NAT MED) 多发性硬化症中髓鞘损伤先于轴突损伤和症状发作
02 (CIRCULATION) 肥厚型心肌病中超收缩性和氧化应激驱动肌酸激酶功能障碍
03 (NAT BIOTECHNOL) AlphaDIA 实现非依赖性迁移学习用于无特征蛋白质组学
04 (NAT GENET) 多模态空间表征肿瘤免疫微环境识别弥漫大B细胞淋巴瘤中的可靶向炎症生态位
05 (J EXTRACELL VESICLES) 来源于间充质干细胞和星形胶质细胞的混合细胞外囊泡用于靶向神经退行性疾病应用

1. (Nature Medicine,IF:58.7) 多发性硬化症中髓鞘损伤先于轴突损伤和症状发作
原文链接: https://www.nature.com/articles/s41591-025-04014-w

2. (Circulation,IF:35.5) 肥厚型心肌病中超收缩性和氧化应激驱动肌酸激酶功能障碍

3. (Nature Biotechnology,IF:33.1) AlphaDIA 实现非依赖性迁移学习用于无特征蛋白质组学

4. (Nature Genetics,IF:31.7) 多模态空间表征肿瘤免疫微环境识别弥漫大B细胞淋巴瘤中的可靶向炎症生态位

5. (Journal of Extracellular Vesicles,IF:15.5) 来源于间充质干细胞和星形胶质细胞的混合细胞外囊泡用于靶向神经退行性疾病应用
加州大学戴维斯分校的 David Wang 团队在《Journal of Extracellular Vesicles》上发表的研究,通过膜融合技术,将间充质干细胞衍生的 EVs 与星形胶质细胞衍生的 EVs 结合,生成了一种新型混合 EV 制剂。这种混合 EV 制剂在神经退行性疾病治疗中具有潜力。
研究利用超分辨率显微镜和定量蛋白质组学分析,对混合 EV 制剂进行了表征和优化,发现其具有脑细胞靶向、神经保护和免疫调节能力,为神经退行性疾病的治疗提供了新思路。
该研究为神经退行性疾病的治疗提供了新的策略和工具,混合 EV 制剂的开发有望突破传统治疗方法的局限,为患者带来更有效的治疗选择,改善神经退行性疾病患者的预后。

研究概览

6. (Nature Communications,IF:14.7) 可扩展近端蛋白质组学的最佳诱饵集计算设计与评估
该研究为近端蛋白质组学技术的发展提供了新的方法和思路,有助于提高蛋白质组学研究的效率和准确性,推动相关领域的研究进展,为生物医学研究提供更有力的技术支持。

GENBAIT 工作流程与评估

7. (Nature Communications,IF:14.7) 冷冻电子断层扫描可视化溶酶体膜蛋白

TRPML1-mNeonGreen-1D4 和 TMEM192-mCherry-1D4 阳性溶酶体的验证

8. (Autophagy,IF:14.6) Entrectinib 通过抑制 OTUD5-MTORC1 信号通路结合 HMGB1 激活心肌细胞自噬诱导心脏毒性

图示:Entrectinib(恩曲替尼)可诱导心肌损伤和左心室功能障碍








