欧米行业动态
1 肺癌第一!2022年中国癌症权威数据发布
2 浙江省癌症5年生存率最新报告发布
3 WHO:2022年全球新增2000万癌症病例和970万例死亡
文献目录
4 纯素与生酮饮食引起的差异性外周免疫特征
5 胰腺导管腺癌前瞻性队列蛋白质组学研究发现预后生物标志物
6 窄窗口数据非依赖性采集(nDIA)实现超快速无标记定量和全面的蛋白质组覆盖
7 人类扁桃体细胞图谱
8 COPDGene和CARDIA肺研究中定量间质异常的蛋白质组生物标志物
9 AI+多组学!“分子双胞胎” 精准平台预测胰腺癌生存
10 大规模血浆蛋白质组学鉴定了与心力衰竭发展相关的新蛋白质和蛋白质网络
11 阿尔茨海默患者脑脊液蛋白质组学揭示具有不同遗传风险特征的五种分子亚型
一起来看看本周蛋白组学领域行业动态和精选优质文献吧!
1. 肺癌第一!2022年中国癌症权威数据发布

2024年2月2日,国家癌症中心(NCC)在 Journal of the National Cancer Center 上公布了2022年中国癌症发病率和死亡率(Cancer incidence and mortality in China, 2022)。
据测算,2022年,我国癌症新发病例约482.47万人,新增癌症死亡病例约257.42万人。排名前五位的癌症类型为肺癌、结直肠癌、甲状腺癌、肝癌和胃癌,占癌症新发病例的57.42%。肺癌、肝癌、胃癌、结直肠癌和食道癌是癌症死亡的前五位癌症,占癌症死亡总数的67.50%。其中,食道癌、胃癌和肝癌的发病率和死亡率呈下降趋势,而甲状腺癌、前列腺癌和宫颈癌的发病率则显着增加。
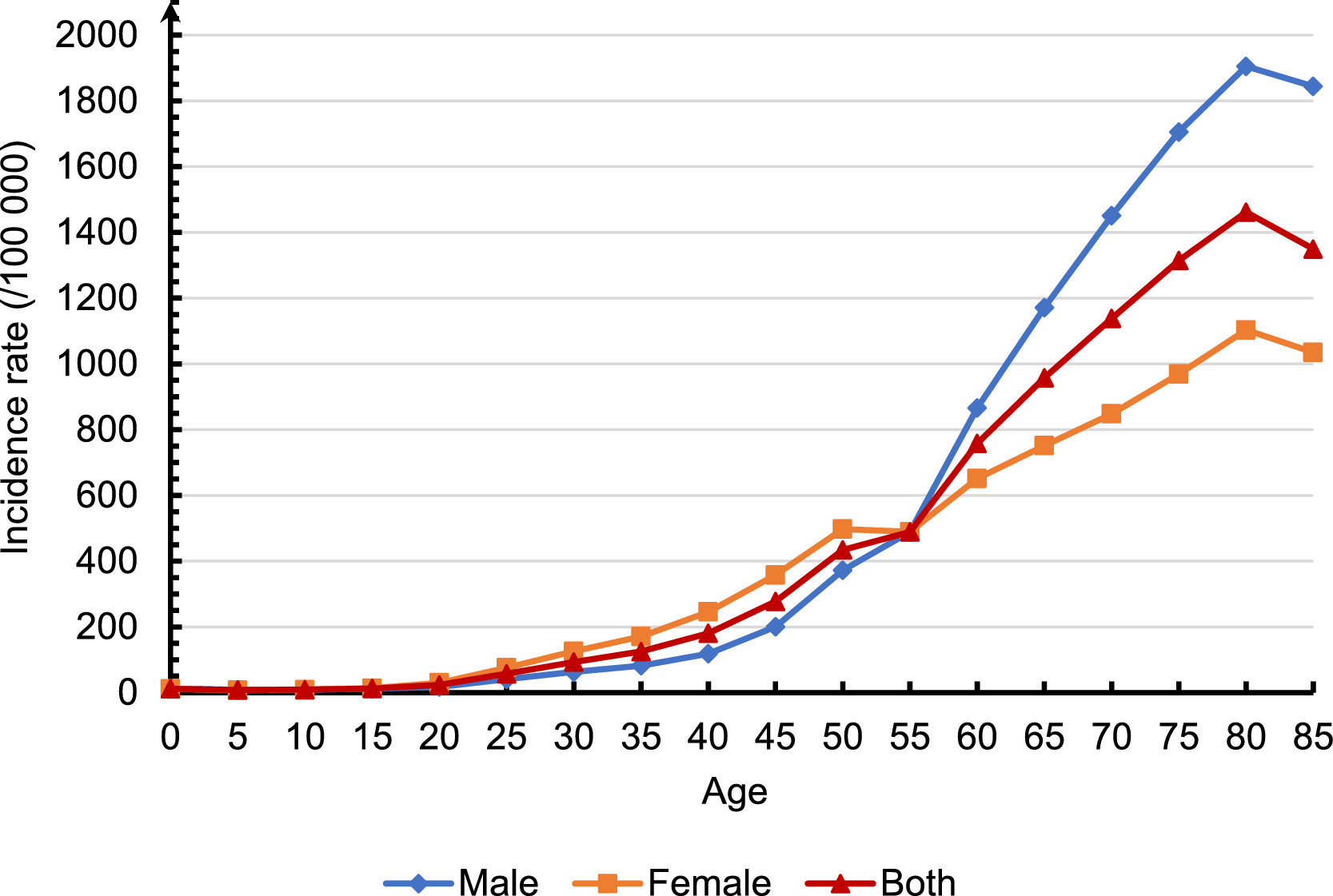
2022 年中国所有癌症的年龄特异性发病
https://www.sciencedirect.com/science/article/pii/S2667005424000061?via%3Dihub
2. 浙江省癌症5年生存率最新报告发布

2023年12月28日,国家癌症中心(NCC)在 Journal of the National Cancer Center 上公布了2018-2019年浙江省人群癌症数据(Cancer survival analysis on population-based cancer registry data in Zhejiang Province, China (2018–2019))。
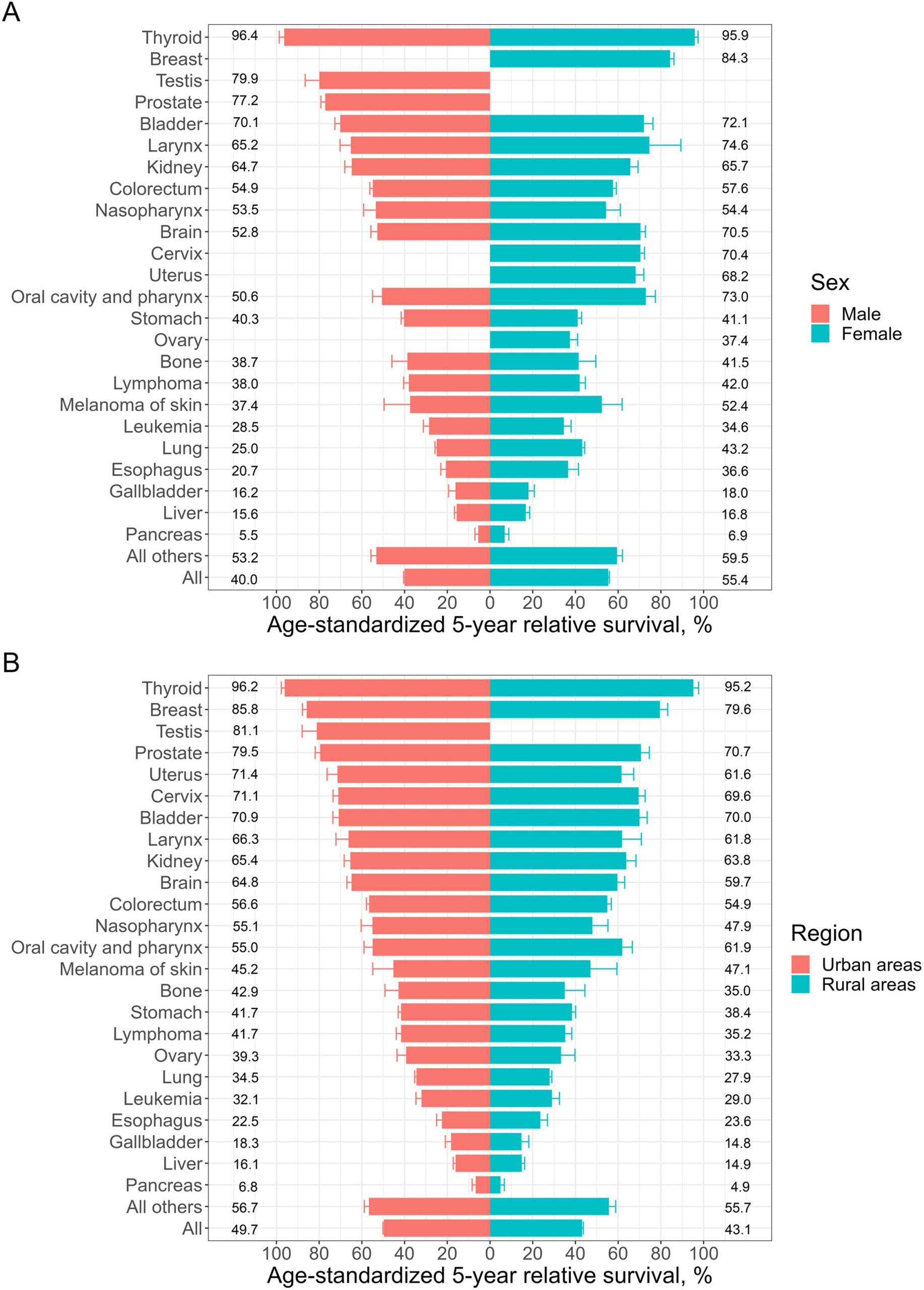
研究纳入了浙江省14个癌症登记处2013年至2017年诊断的255,725名肿瘤患者,并随访至2019年。结果显示,2018-2019年期间浙江省肿瘤患者的5年相对生存率为47.5%,高于国家癌症中心报告的全国平均水平40.5%(2012-2015年)。
女性肿瘤患者的5年相对生存率(55.4%)高于男性(40.0%),城市地区(49.7%)高于农村地区(43.1%)。其中,5年相对生存率前五位肿瘤类型分别是甲状腺癌(96.0%)、乳腺癌(84.3%)、睾丸癌(79.9%)、前列腺癌(77.2%)和膀胱癌(70.6%)。而排名最后的五类肿瘤分别是胰腺癌(6.0%)、肝癌(15.6%)、胆囊癌(17.1%)、食管癌(22.7%)和白血病(31.0%)。
https://www.sciencedirect.com/science/article/pii/S2667005423000856
3. WHO:2022年全球新增2000万癌症病例和970万例死亡
2024年2月1日,WHO下属国际癌症研究机构(IARC)发布了全球癌症负担的最新估计数据。数据显示,2022 年,全球有2000万新发癌症病例和970万人死亡。据估计,癌症诊断后5年内存活的人数为5350万人。大约五分之一的人在一生中患上癌症,大约九分之一的男性和十二分之一的女性死于癌症。
其中,肺癌是全球最常见的癌症,新增病例 250 万例,占新增病例总数的 12.4%。女性乳腺癌位居第二(230 万例,占 11.6%),其次是结直肠癌(190 万例,占 9.6%)、前列腺癌(150 万例,占 7.3%)和胃癌(97 万例,占 4.9%)。
肺癌也是癌症死亡的首要原因(180 万人死亡,占癌症死亡总数的 18.7%),其次是结肠直肠癌(90 万人死亡,占 9.3%)、肝癌(76 万人死亡,占 7.8%)、乳腺癌(67万人死亡,占 6.9%)和胃癌(66 万人死亡,占 6.8%)。报告还指出,肺癌重新成为最常见的癌症可能与亚洲人群持续吸烟有关。
数据显示,预计 2050 年新增癌症病例将超过3500万,相比2022年的2000万例激增77%!WHO指出,全球癌症负担的快速增长反映了人口老龄化和增长,烟草、酒精和肥胖是癌症发病率上升的关键因素,而空气污染仍然是环境风险因素的主要驱动因素。
https://www.who.int/news/item/01-02-2024-global-cancer-burden-growing--amidst-mounting-need-for-services
4.(Nature Medicine,IF:82.9)纯素食与生酮饮食引起的差异性外周免疫特征

营养对所有生理过程都有广泛的影响。然而,营养如何影响人体免疫力在很大程度上仍是未知数。研究人员通过对一项临床试验进行事后分析,探讨了饮食干预对免疫力和微生物群的影响。
在这项临床试验中,20名参与者依次食用纯素食或生酮饮食2周。研究人员采用多组学方法(包括多维流式细胞术、转录组学、蛋白质组学、代谢组学和宏基因组学数据集),评估了每种饮食和饮食转换对宿主免疫力和微生物群的影响。
结果显示,总体而言,生酮饮食与适应性免疫系统相关通路的显著上调和细胞的富集有关。相比之下,素食对先天性免疫系统有显著影响,包括上调与抗病毒免疫相关的通路。两种饮食都对微生物组和宿主相关氨基酸代谢产生了明显的不同影响,与基线饮食和纯素饮食相比,生酮饮食对大多数微生物通路产生了强烈的下调作用。尽管参与者多种多样,研究人员也观察到数据集之间由氨基酸、脂类和免疫系统相关化合物驱动的紧密联系网络。
总之,这项研究表明,在不同的参与者中,2周的控制饮食干预足以对宿主免疫系统产生显著而不同的影响,这可能会对精准营养干预产生影响。
https://www.nature.com/articles/s41591-023-02761-2
5.(Nature Medicine,IF:82.9)胰腺导管腺癌前瞻性队列蛋白质组学研究发现预后生物标志物

辅助化疗可使切除的胰腺导管腺癌(PDAC)患者获益,但术后患者的身体状况会影响其依从性,因此我们需要生物标志物来确定是否需要及时进行辅助治疗。
这项前瞻性观察研究纳入了1171名接受胰腺切除术的PDAC患者并进行了广泛随访。对191份患者样本进行的蛋白质组分析揭示了与临床相关的功能蛋白模块。研究人员建立了蛋白质组学水平的 PDAC 预后风险模型,并利用公开的外部队列进一步验证了该模型的实用性。
更重要的是,通过利用临床和蛋白质组数据集进行交互效应回归分析,研究人员发现了两个生物标志物(NDUFB8和CEMIP2),它们表明了PDAC患者对辅助化疗的整体敏感性。这些生物标记物通过免疫组化技术在386例患者的内部队列以及两个外部多中心队列(230名患者的法国多中心队列、466名患者的中国两家三甲医院队列)中都得到了验证,增强了研究结果的稳健性和可推广性。
此外,研究人员还在PDAC细胞系和患者衍生的器官组织上通过功能测试进行了实验验证。总之,该研究在队列规模上整合了临床和蛋白质组数据,证明了蛋白质组学指导预后和生物标志物辅助PDAC辅助化疗的潜力。
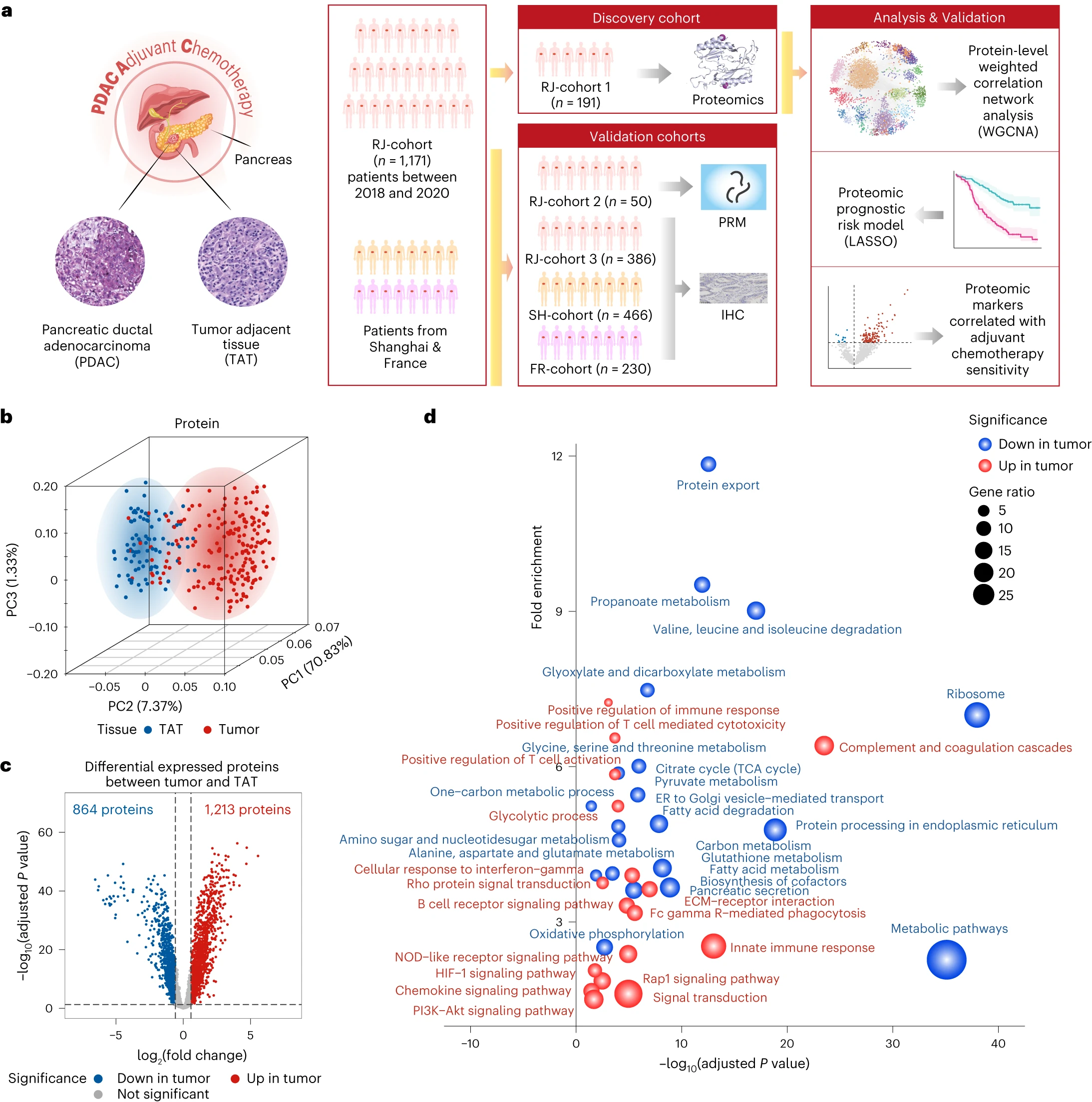
https://www.nature.com/articles/s41591-023-02790-x
6.(Nature Biotechnology,IF=46.9)窄窗口数据非依赖性采集(nDIA)实现超快速无标记定量和全面的蛋白质组覆盖

研究人员介绍了窄窗口式数据非依赖性采集(narrow-window data-independent acquisition,nDIA)的质谱策略,包括高分辨率 MS1 扫描和使用 2-Th 隔离窗的约200 Hz并行串联质谱(MS/MS)扫描,可消除DDA和DIA方法之间的差异。这一目标是这是通过将四极杆Orbitrap质谱仪与非对称轨道无损质量分析器Astral配对实现的。该技术允许在较短的液相色谱-质谱(LC-MS/MS)分析时间内进行高通量、深度蛋白质组覆盖和准确定量。
使用nDIA 策略,每天可分析>100个完整的酵母蛋白质组;或每天分析48个人类蛋白质组,半小时内可分析约10,000个人类蛋白质组;或者在5分钟内对约7,000个蛋白质进行分析,相比当前先进的质谱技术,覆盖范围提高了3倍。对离线分馏样品进行多次采集,可在约 3 小时内全面覆盖人类蛋白质组。在三物种蛋白质组混合物中,单次半小时运行可量化 14,000 多个蛋白质组,显示了较高的定量精度(precision)和准确度(accuracy)。
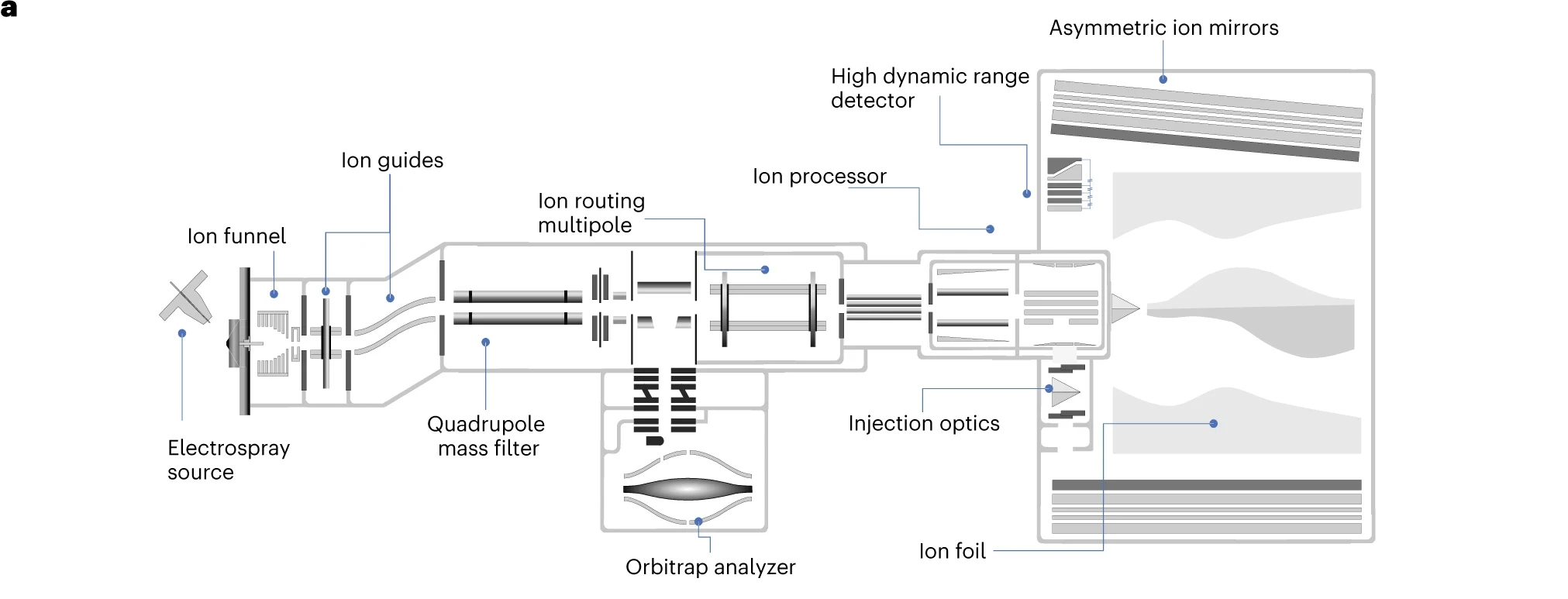
https://www.nature.com/articles/s41587-023-02099-7
7.(Immunity,IF: 32.4)人类扁桃体细胞图谱

腭扁桃体是次级淋巴器官(SLO),代表着抵御吸入或摄入病原体的第一道免疫防线。研究人员绘制了人类扁桃体图谱,图谱由超过556,000个细胞组成,采用了五种不同的数据模式进行分析,包括单细胞转录组、表观基因组、蛋白质组和免疫组库测序以及空间转录组学。这次普查确定了121种细胞类型和状态,定义了发育轨迹,并了解了扁桃体的功能单元。
例如,研究人员对髓样扁桃体亚型进行了分层,确定了在滤泡相关 T 细胞和 B 细胞中局部活跃的 BCL6 增强子,并发现 SIX5 是浆细胞成熟的假定转录调节因子。对验证队列的分析证实了扁桃体细胞类型的存在、注释和标记,并提供了与年龄相关的组成变化的证据。研究人员对来自 B 细胞的套细胞淋巴瘤细胞进行了注释,将转录异质性与人类扁桃体的正常 B 细胞分化状态联系起来,从而证明了这一资源的价值。
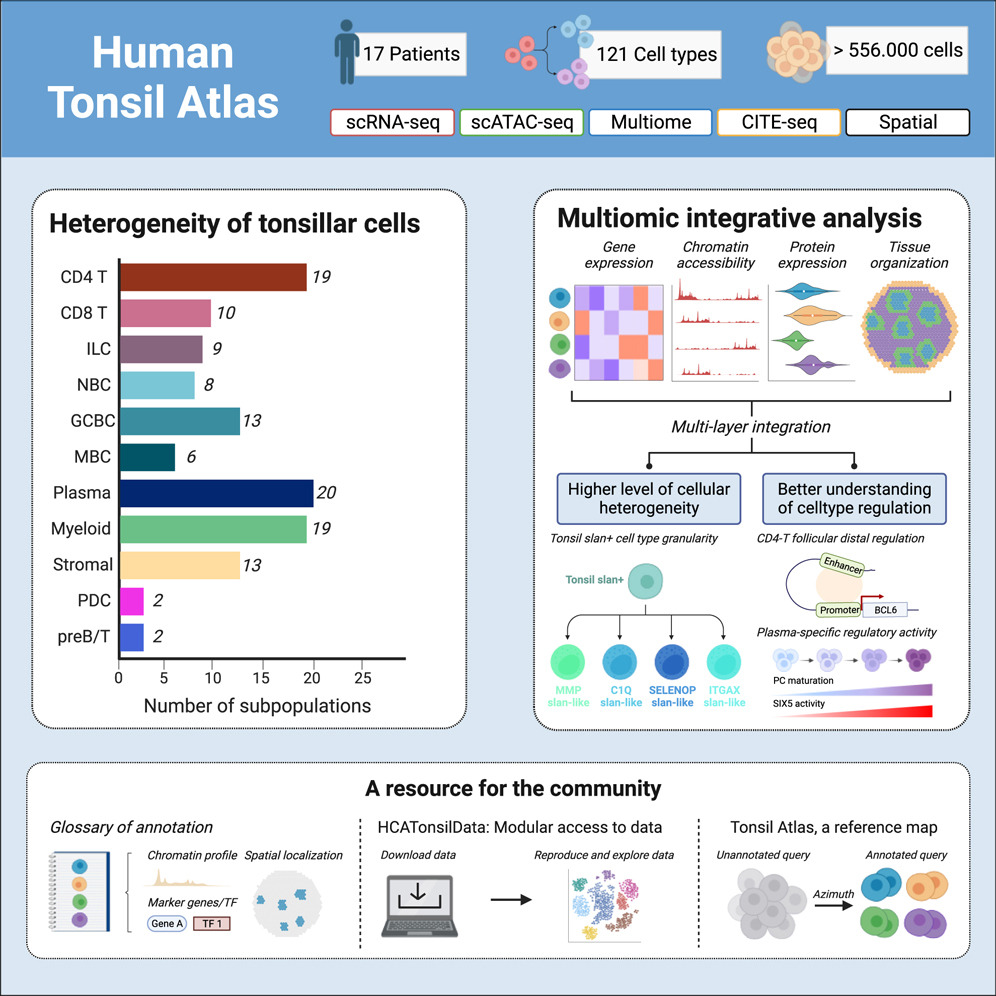
https://doi.org/10.1016/j.immuni.2024.01.006
8.(Am J Respir Crit Care Med,IF:24.7)COPDGene和CARDIA肺研究中定量间质异常的蛋白质组生物标志物

定量间质异常(QIA)是胸部CT中自动检测到的肺损伤的早期指标。QIA与呼吸系统健康受损有关,并与晚期肺部疾病具有相同的特征,但其生物学基础尚不十分清楚。
研究人员分析了两个多中心队列中的高通量血浆蛋白质组,以确定QIA的新型蛋白质生物标记物。他们测量了4383名年龄较大、曾经吸烟者队列(慢性阻塞性肺病遗传流行病学,COPDGene)参与者和 2925 名年轻人群队列(年轻人冠状动脉疾病风险,CARDIA)参与者的血浆蛋白质组学。使用多变量线性回归模型评估了蛋白质组学水平与QIA之间的关联,并对年龄、性别、体重指数、吸烟状况和研究中心进行了调整。
结果显示,在COPDGene中,852个蛋白质与QIA显著相关,在CARDIA中,185个蛋白质与QIA显著相关。在COPDGene和CARDIA中重叠的144个蛋白质中,除一种蛋白质外,其他所有蛋白质的方向和大小都相同。这些蛋白质富集在49个基因本体通路中,包括炎症反应、细胞粘附、免疫反应、ERK1/2调节和信号传导中的生物过程;细胞外区域中的细胞成分;以及包括钙离子和肝素结合在内的分子功能。
总的来说,研究人员在肺病发病率较高的老年吸烟人群和较年轻、较健康的社区人群中发现了QIA的蛋白质组学生物标志物。这些蛋白质组学特征可能是晚期肺病早期前兆的标志物。
https://www.atsjournals.org/doi/10.1164/rccm.202307-1129OC
9.(Nature Cancer,IF:22.7)AI+多组学!“分子双胞胎” 精准平台预测胰腺癌生存

目前的分析主要集中在数量有限的临床和分子生物标志物上,无法准确预测胰腺导管腺癌的临床结果。在这里,研究人员描述了一个由先进的机器学习模型组成的精准医疗平台——“分子双胞胎”(Molecular Twin),并用它来分析切除的胰腺导管腺癌患者的6363个临床和多组学分子特征数据集,以准确预测疾病生存期(DS)。
研究表明,完整的多组学模型预测疾病存活率的准确率最高,而血浆蛋白是预测疾病存活率最高的单组学指标。仅学习589个多组学特征的简约模型与完整的多原子模型具有相似的预测性能。该平台可以发现简约的生物标记物panel,并对从资源密集型panel学习的结果预测模型进行性能评估。这种方法具有相当大的潜力,可以影响临床治疗并助力癌症精准医疗。
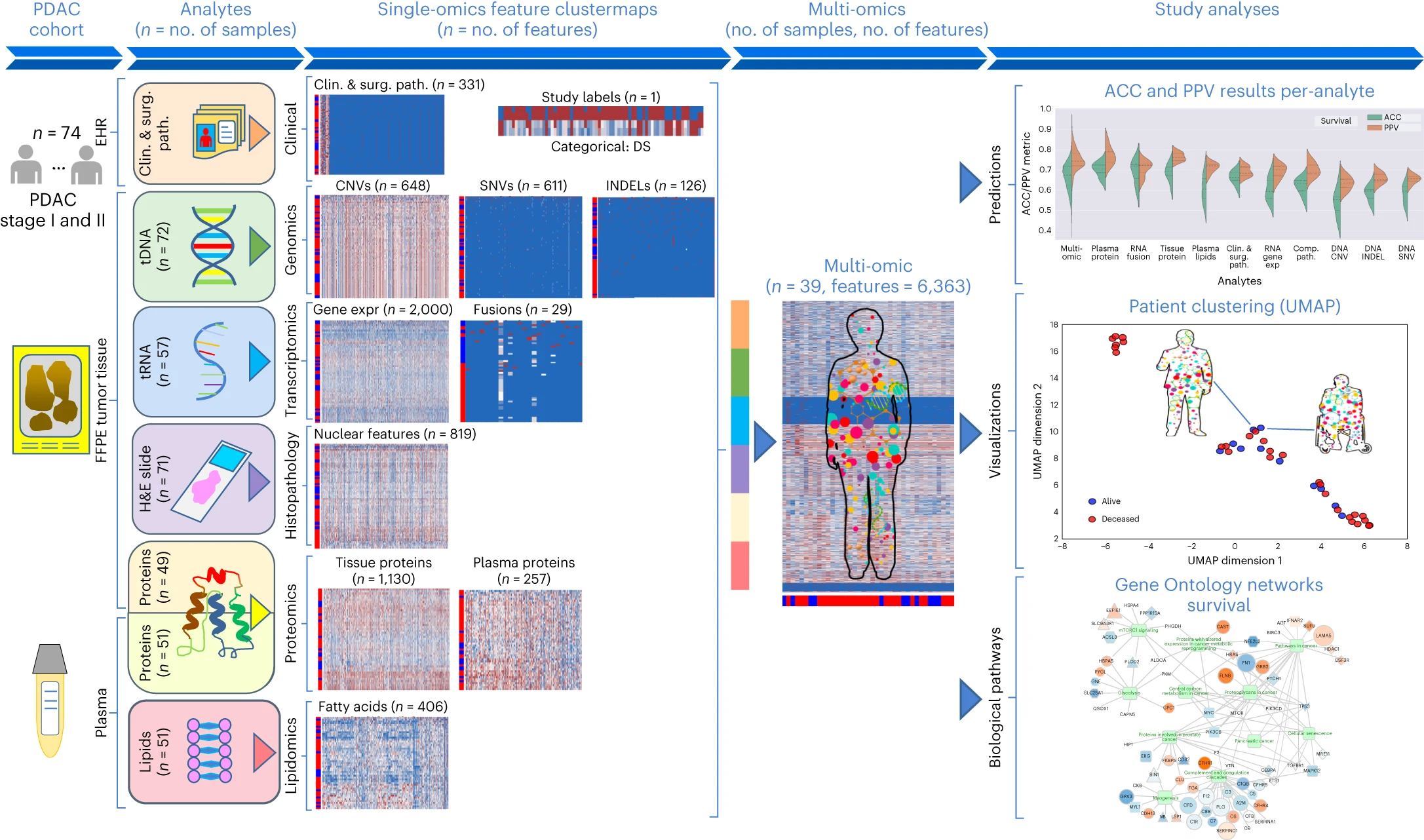
https://www.nature.com/articles/s43018-023-00697-7
10.(Nature Communications,IF:16.6)大规模血浆蛋白质组学鉴定了与心力衰竭发展相关的新蛋白质和蛋白质网络

心力衰竭(HF)会导致严重的发病率和死亡率,但人们对其病理学的了解尚不清楚。研究人员测量了13,900名无高血压患者的4877种血浆蛋白质,通过三个不同年龄、地域和心力衰竭确定的分析集来确定与心力衰竭发展相关的循环蛋白质和蛋白质网络。
研究人员对社区动脉粥样硬化风险研究的中年和晚年参与者以及特伦德拉格健康研究的参与者进行了平行分析,发现了37种与心力衰竭事件相关的蛋白质,这些蛋白质不受传统风险因素的影响。孟德尔随机分析支持10种心力衰竭、心力衰竭危险因素或左心室大小和功能的因果影响,包括基质细胞蛋白(如 SPON1、MFAP4)、衰老相关蛋白(FSTL3、IGFBP7)和炎症蛋白(SVEP1、CCL15、ITIH3)。蛋白共调节网络分析确定了与心力衰竭风险相关的5个模块,其中两个受到了涉及VTN和CFH基因的转座位点的遗传变异的影响。
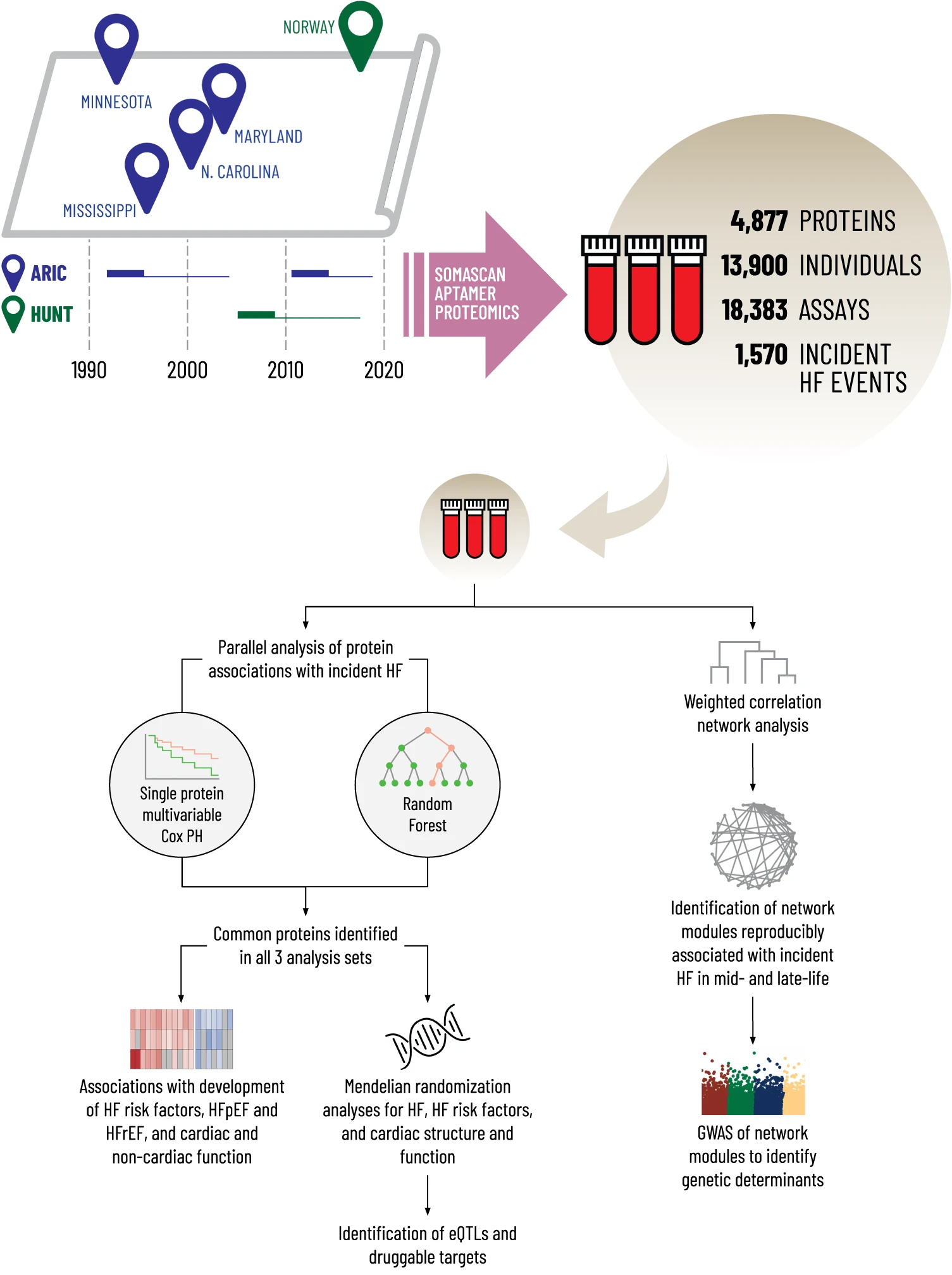
https://www.nature.com/articles/s41467-023-44680-3
11.(Nature Aging,IF:16.6)阿尔茨海默患者脑脊液蛋白质组学揭示具有不同遗传风险特征的五种分子亚型

阿尔茨海默病(AD)在分子水平上具有异质性,了解这种异质性对于疾病药物的开发至关重要。研究人员利用质谱蛋白质组学对AD患者脑脊液中的1,058种蛋白质进行分析,确定了阿兹海默症分子亚型,与对照组(187人)相比,AD患者(419人)的蛋白质水平有所不同。
这些AD亚型的蛋白质水平变化与不同的分子过程有关:亚型1的蛋白质与神经元过度增生有关;亚型2与先天性免疫激活有关;亚型3与RNA失调有关;亚型4与脉络丛功能障碍有关;亚型5与血脑屏障受损有关。
每个亚型都与特定的AD遗传风险变异有关,例如,亚型1富含TREM2 R47H。不同亚型的临床结果、存活时间和脑萎缩的解剖模式也各不相同。这些结果表明了AD的分子异质性,并强调了个性化医疗的必要性。
https://www.nature.com/articles/s43587-023-00550-7
https://www.nature.com/articles/s43587-023-00550-7