
研究背景及简介
"千里之堤毁于蚁穴,万丈高楼平地起。" 在精准医学的漫长征程中,任何微小的突变或缺失都可能对疾病的治疗产生深远的影响。这篇研究揭示了一个微观世界中深刻的变化:ARID1A基因的缺失如何引发一系列的分子级反应,最终导致EGFR突变型肺腺癌(LUAD)患者在接受奥希替尼治疗时的耐药性。
2025年1月,来自中国医学科学院肿瘤医院的研究团队,在Experimental Hematology & Oncology期刊上发表题为 A cohort-based multi-omics identifies nuclear translocation of eIF5B/PD-L1/CD44 complex as the target to overcome Osimertinib resistance of ARID1A-deficient lung adenocarcinoma的文章,本文的主要作者包括Dantong Sun、Helei Hou、Feiyue Feng、Weizheng Wu等。
非小细胞肺癌(LUAD)是最常见的肺癌类型,约40%的亚洲LUAD患者具有EGFR突变,能从靶向药物如EGFR酪氨酸激酶抑制剂(TKIs)中获益。然而,尽管第三代EGFR-TKI药物Osimertinib在治疗中显示出显著效果,但部分患者最终会出现耐药性 。这篇文章的研究正是围绕这一关键问题展开,通过对ARID1A缺失的非小细胞肺癌患者的多组学分析,探讨了Osimertinib耐药的新机制。西湖欧米为本研究提供了空间蛋白质组检测服务。
在EGFR突变型非小细胞肺癌(NSCLC)中,奥希替尼(Osimertinib)作为一种第三代EGFR酪氨酸激酶抑制剂(TKI),已成为标准治疗。然而,约30%-40%的患者会在治疗过程中发展出耐药性,这使得奥希替尼的临床效果大打折扣。本文聚焦于ARID1A缺失这一因素,探索其在奥希替尼耐药机制中的关键作用,并提出潜在的治疗策略。
研究样本
本文的研究基于101名EGFR突变型肺腺癌(LUAD)患者的临床样本,通过多种组学技术,如蛋白质组学、转录组学及空间组学分析,深入探讨了ARID1A缺失在奥希替尼耐药性中的分子机制,为临床应用提供了重要的实验依据。
研究方法
空间转录组学与蛋白质组学(西湖欧米为本研究提供了空间蛋白组学检测服务):通过对患者组织样本进行空间组学分析,揭示ARID1A缺失与PD-L1核转位之间的关系。

质谱与RNA-seq:进一步验证通过Co-IP、ChIP-seq等技术分析ARID1A缺失后所激活的蛋白质复合物。 细胞与小鼠模型:在细胞系和小鼠异种移植模型中验证ARID1A缺失引起的耐药性机制。
研究结果
1. ARID1A缺失通过EZH2/PTEN/E2F1轴阻碍细胞程序性死亡
ARID1A是SWI/SNF染色质重塑复合体的一个重要亚单位,参与调节细胞功能和基因表达。在LUAD细胞中,ARID1A的缺失导致其通过EZH2/PTEN/E2F1轴影响PD-L1的转录与翻译。ARID1A缺失还导致eIF5B和Importin-β1的上调,这些分子有助于PD-L1进入细胞核,形成核PD-L1(nPD-L1)复合物,进而激活RASGEF1A基因的启动子,启动Ras信号通路,最终导致耐药性。
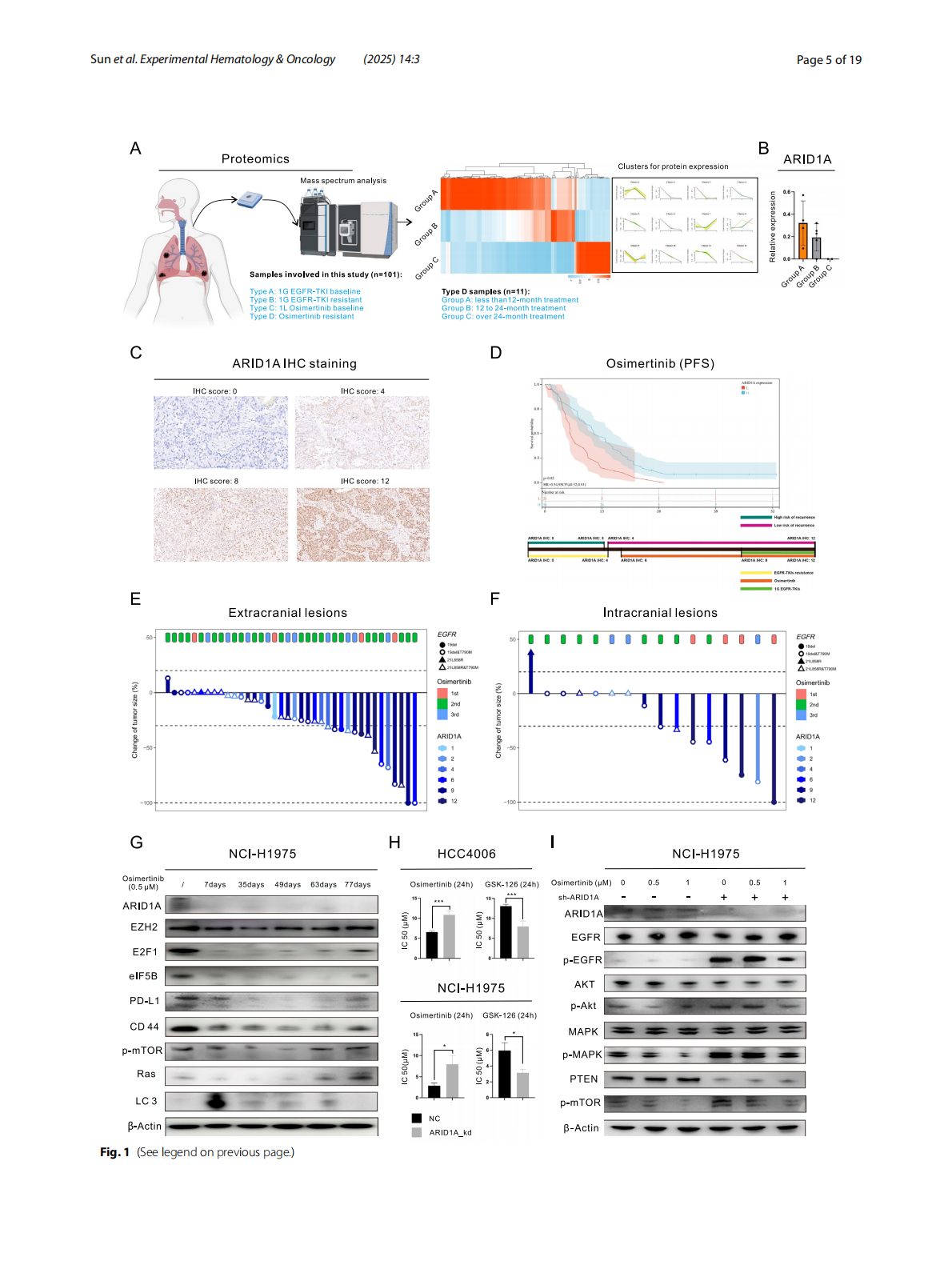
2. ARID1A缺失通过MDM2/eIF5B/PD-L1轴上调PD-L1表达与核转位
研究发现,E2F1上调MDM2,进而促进PD-L1的翻译与稳定性;eIF5B作为翻译起始因子结合PD-L1 mRNA,并协助其核转位。
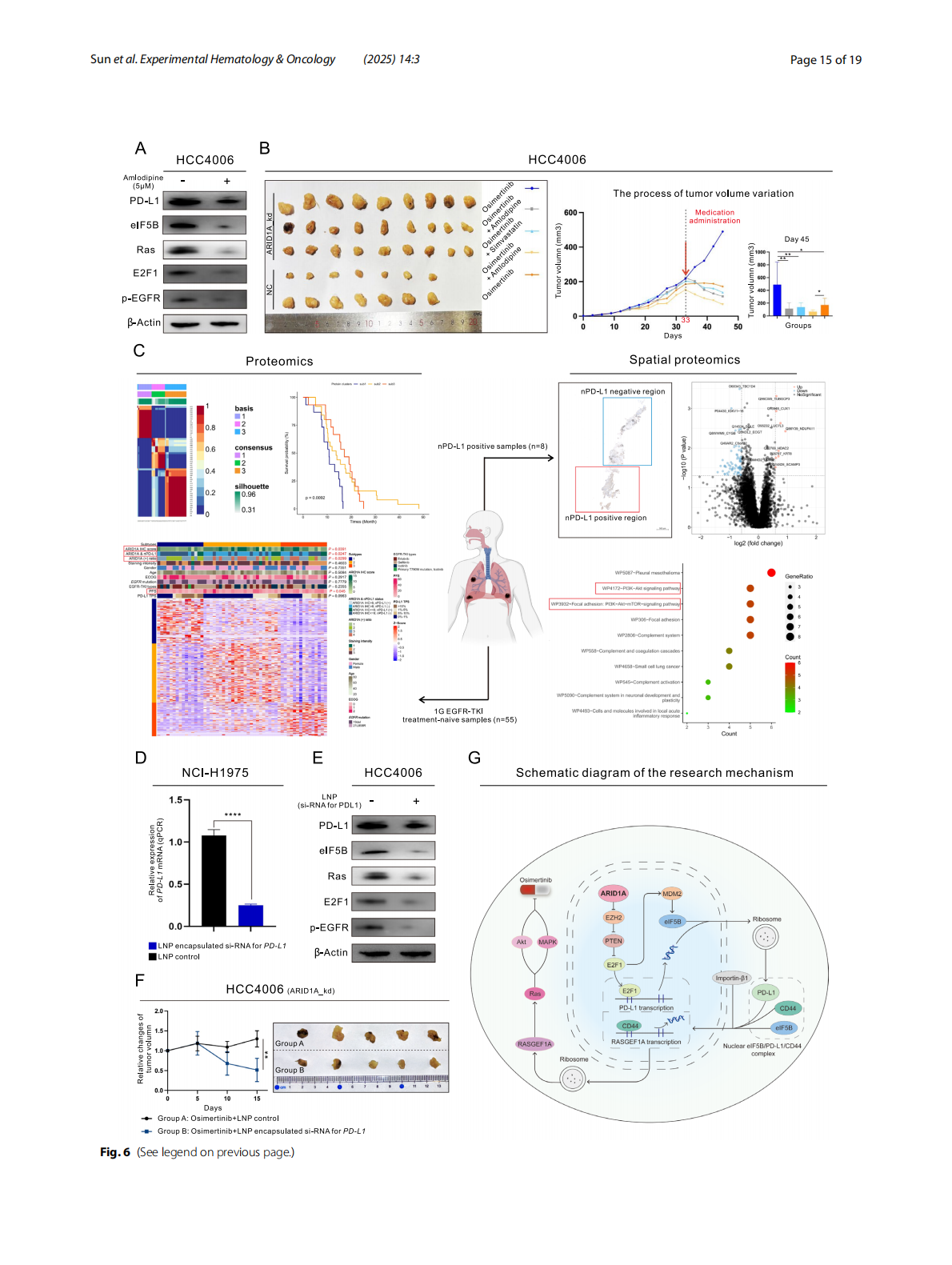
3. PD-L1在核内结合CD44形成复合物,驱动RASGEF1A转录激活RAS通路
PD-L1在eIF5B和Importin-β1协助下进入细胞核,携带CD44共同激活RASGEF1A启动子,增强RAS信号通路。
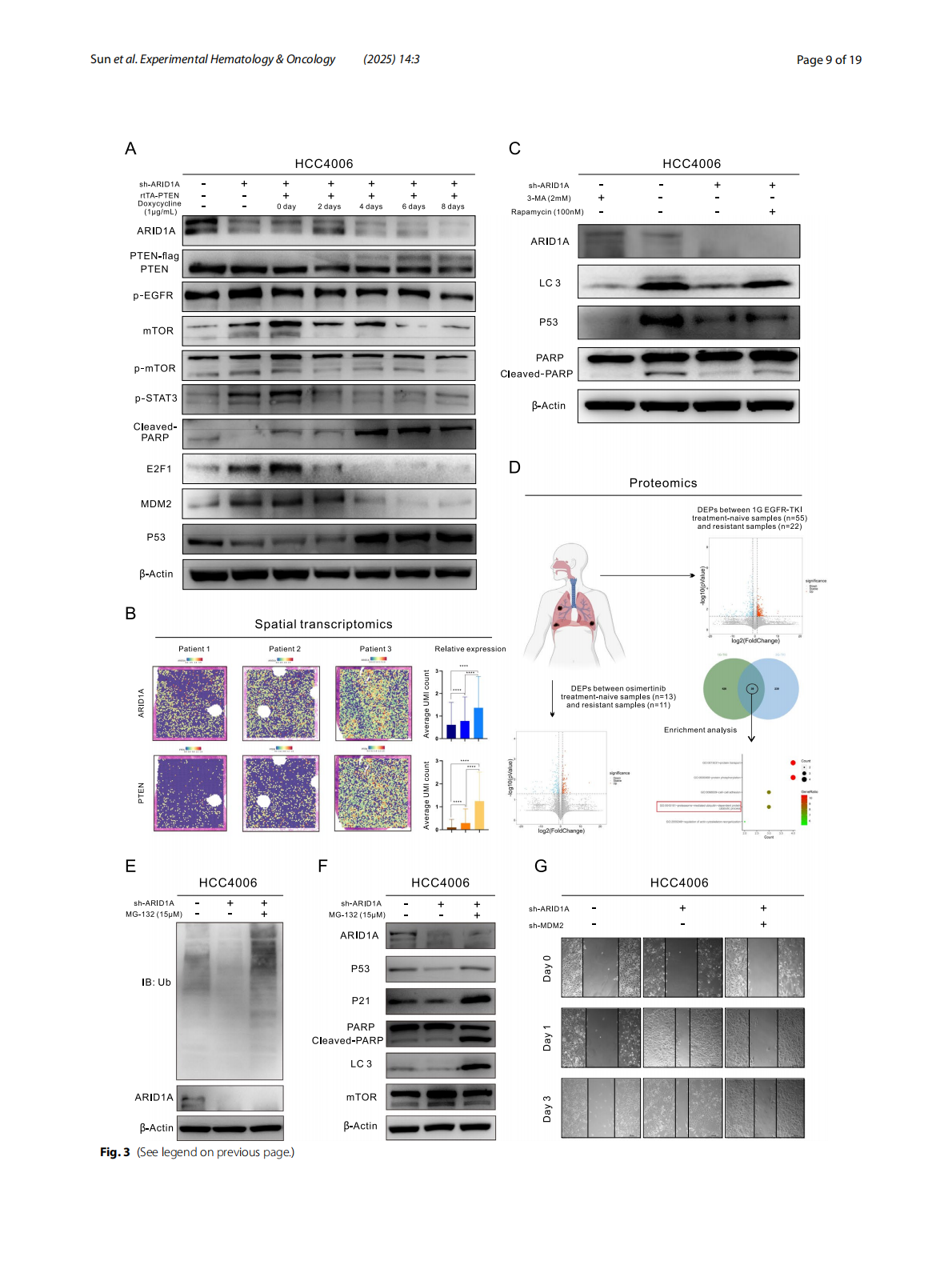
4. 靶向治疗的潜在前景
研究还提出,抑制EZH2、E2F1或eIF5B等靶点可以有效恢复奥希替尼的敏感性,尤其是在ARID1A缺失的LUAD细胞中。这为未来的治疗提供了新的策略。
文章小结
本研究揭示了ARID1A缺失在肺腺癌奥希替尼耐药性中的关键作用,重点突出了PD-L1的核转位及其与CD44的相互作用。未来的研究可能会围绕这些新的靶点(如eIF5B、EZH2、E2F1)进行,开发出更有效的治疗策略。同时,基于脂质纳米颗粒(LNPs)的药物递送系统为靶向治疗提供了新的前景。
同时,本研究通过空间蛋白质组技术精准捕捉PD-L1在肿瘤组织中的亚细胞定位,揭示PD-L1核转位与耐药机制之间的直接关联,强调“空间位置”在蛋白功能与耐药机制解析中的关键作用,展现了空间蛋白质组学在肿瘤机制研究和新靶点发现中的巨大潜力。
在精准医学与药物研发的前沿,科技的每一步进展都可能为我们带来更具希望的治疗选择。正如这项研究所示,细微的分子变化决定了癌症治疗的成败,了解这些机制将是战胜癌症的关键。
论文:https://doi.org/10.1186/s40164-024-00594-4
声明:本文内容基于期刊公开信息整理,中文解读及科普文字由多个AI 助手生成,旨在帮助大众快速理解前沿研究,不构成任何专业建议或诊断依据。如需实验或临床应用,请以原始文献与专业人士意见为准。

研究背景及简介
"千里之堤毁于蚁穴,万丈高楼平地起。" 在精准医学的漫长征程中,任何微小的突变或缺失都可能对疾病的治疗产生深远的影响。这篇研究揭示了一个微观世界中深刻的变化:ARID1A基因的缺失如何引发一系列的分子级反应,最终导致EGFR突变型肺腺癌(LUAD)患者在接受奥希替尼治疗时的耐药性。
2025年1月,来自中国医学科学院肿瘤医院的研究团队,在Experimental Hematology & Oncology期刊上发表题为 A cohort-based multi-omics identifies nuclear translocation of eIF5B/PD-L1/CD44 complex as the target to overcome Osimertinib resistance of ARID1A-deficient lung adenocarcinoma的文章,本文的主要作者包括Dantong Sun、Helei Hou、Feiyue Feng、Weizheng Wu等。
非小细胞肺癌(LUAD)是最常见的肺癌类型,约40%的亚洲LUAD患者具有EGFR突变,能从靶向药物如EGFR酪氨酸激酶抑制剂(TKIs)中获益。然而,尽管第三代EGFR-TKI药物Osimertinib在治疗中显示出显著效果,但部分患者最终会出现耐药性 。这篇文章的研究正是围绕这一关键问题展开,通过对ARID1A缺失的非小细胞肺癌患者的多组学分析,探讨了Osimertinib耐药的新机制。西湖欧米为本研究提供了空间蛋白质组检测服务。
在EGFR突变型非小细胞肺癌(NSCLC)中,奥希替尼(Osimertinib)作为一种第三代EGFR酪氨酸激酶抑制剂(TKI),已成为标准治疗。然而,约30%-40%的患者会在治疗过程中发展出耐药性,这使得奥希替尼的临床效果大打折扣。本文聚焦于ARID1A缺失这一因素,探索其在奥希替尼耐药机制中的关键作用,并提出潜在的治疗策略。
研究样本
本文的研究基于101名EGFR突变型肺腺癌(LUAD)患者的临床样本,通过多种组学技术,如蛋白质组学、转录组学及空间组学分析,深入探讨了ARID1A缺失在奥希替尼耐药性中的分子机制,为临床应用提供了重要的实验依据。
研究方法
空间转录组学与蛋白质组学(西湖欧米为本研究提供了空间蛋白组学检测服务):通过对患者组织样本进行空间组学分析,揭示ARID1A缺失与PD-L1核转位之间的关系。

质谱与RNA-seq:进一步验证通过Co-IP、ChIP-seq等技术分析ARID1A缺失后所激活的蛋白质复合物。 细胞与小鼠模型:在细胞系和小鼠异种移植模型中验证ARID1A缺失引起的耐药性机制。
研究结果
1. ARID1A缺失通过EZH2/PTEN/E2F1轴阻碍细胞程序性死亡
ARID1A是SWI/SNF染色质重塑复合体的一个重要亚单位,参与调节细胞功能和基因表达。在LUAD细胞中,ARID1A的缺失导致其通过EZH2/PTEN/E2F1轴影响PD-L1的转录与翻译。ARID1A缺失还导致eIF5B和Importin-β1的上调,这些分子有助于PD-L1进入细胞核,形成核PD-L1(nPD-L1)复合物,进而激活RASGEF1A基因的启动子,启动Ras信号通路,最终导致耐药性。

2. ARID1A缺失通过MDM2/eIF5B/PD-L1轴上调PD-L1表达与核转位
研究发现,E2F1上调MDM2,进而促进PD-L1的翻译与稳定性;eIF5B作为翻译起始因子结合PD-L1 mRNA,并协助其核转位。

3. PD-L1在核内结合CD44形成复合物,驱动RASGEF1A转录激活RAS通路
PD-L1在eIF5B和Importin-β1协助下进入细胞核,携带CD44共同激活RASGEF1A启动子,增强RAS信号通路。

4. 靶向治疗的潜在前景
研究还提出,抑制EZH2、E2F1或eIF5B等靶点可以有效恢复奥希替尼的敏感性,尤其是在ARID1A缺失的LUAD细胞中。这为未来的治疗提供了新的策略。
文章小结
本研究揭示了ARID1A缺失在肺腺癌奥希替尼耐药性中的关键作用,重点突出了PD-L1的核转位及其与CD44的相互作用。未来的研究可能会围绕这些新的靶点(如eIF5B、EZH2、E2F1)进行,开发出更有效的治疗策略。同时,基于脂质纳米颗粒(LNPs)的药物递送系统为靶向治疗提供了新的前景。
同时,本研究通过空间蛋白质组技术精准捕捉PD-L1在肿瘤组织中的亚细胞定位,揭示PD-L1核转位与耐药机制之间的直接关联,强调“空间位置”在蛋白功能与耐药机制解析中的关键作用,展现了空间蛋白质组学在肿瘤机制研究和新靶点发现中的巨大潜力。
在精准医学与药物研发的前沿,科技的每一步进展都可能为我们带来更具希望的治疗选择。正如这项研究所示,细微的分子变化决定了癌症治疗的成败,了解这些机制将是战胜癌症的关键。
论文:https://doi.org/10.1186/s40164-024-00594-4
声明:本文内容基于期刊公开信息整理,中文解读及科普文字由多个AI 助手生成,旨在帮助大众快速理解前沿研究,不构成任何专业建议或诊断依据。如需实验或临床应用,请以原始文献与专业人士意见为准。







