人,就像一部精密的交响乐,每个音符(蛋白质)都在配合演奏生命的乐章。年轻时,乐队配合无间,旋律流畅;可随着岁月的流逝,有的乐器开始跑调,有的甚至沉默不奏——这便是衰老。2025年7月25日,Cell期刊发表的一项题为"Comprehensive human proteome profiles across a 50-year lifespan reveal aging trajectories and signatures"的研究,就像一位细心的指挥家,重新审视这部生命交响曲,找到了音符错乱的原因。它不仅让我们窥见衰老背后的分子秘密,也为未来如何“调音”延缓衰老提供了灵感。或许,有一天,我们能让这首生命的乐章演奏得更久、更动听。

图1 文章截图
该研究揭示了衰老过程中蛋白质的变化、衰老标记物的识别,进一步推动了我们对衰老和相关疾病的认知。今天,让我们一起走进这项研究,了解蛋白质组学如何揭示衰老奥秘,并为未来的疾病预防和治疗提供新线索。这项由中国科学院等多个科研机构联合进行的研究,收集了13种不同人体组织的516个样本,涵盖了从14岁到68岁的个体。研究团队利用先进的质谱技术对这些样本进行了蛋白质的定量分析,结合转录组学数据,揭示了不同年龄段、不同组织中的蛋白质变化。通过这一方法,研究人员建立了一个跨越50年的人类衰老蛋白质组图谱,全面展示了衰老过程中的蛋白质变化。

图2 A multi-tissue proteomic atlas outlines age- and tissue-associated protein features
01
蛋白质与转录组脱钩
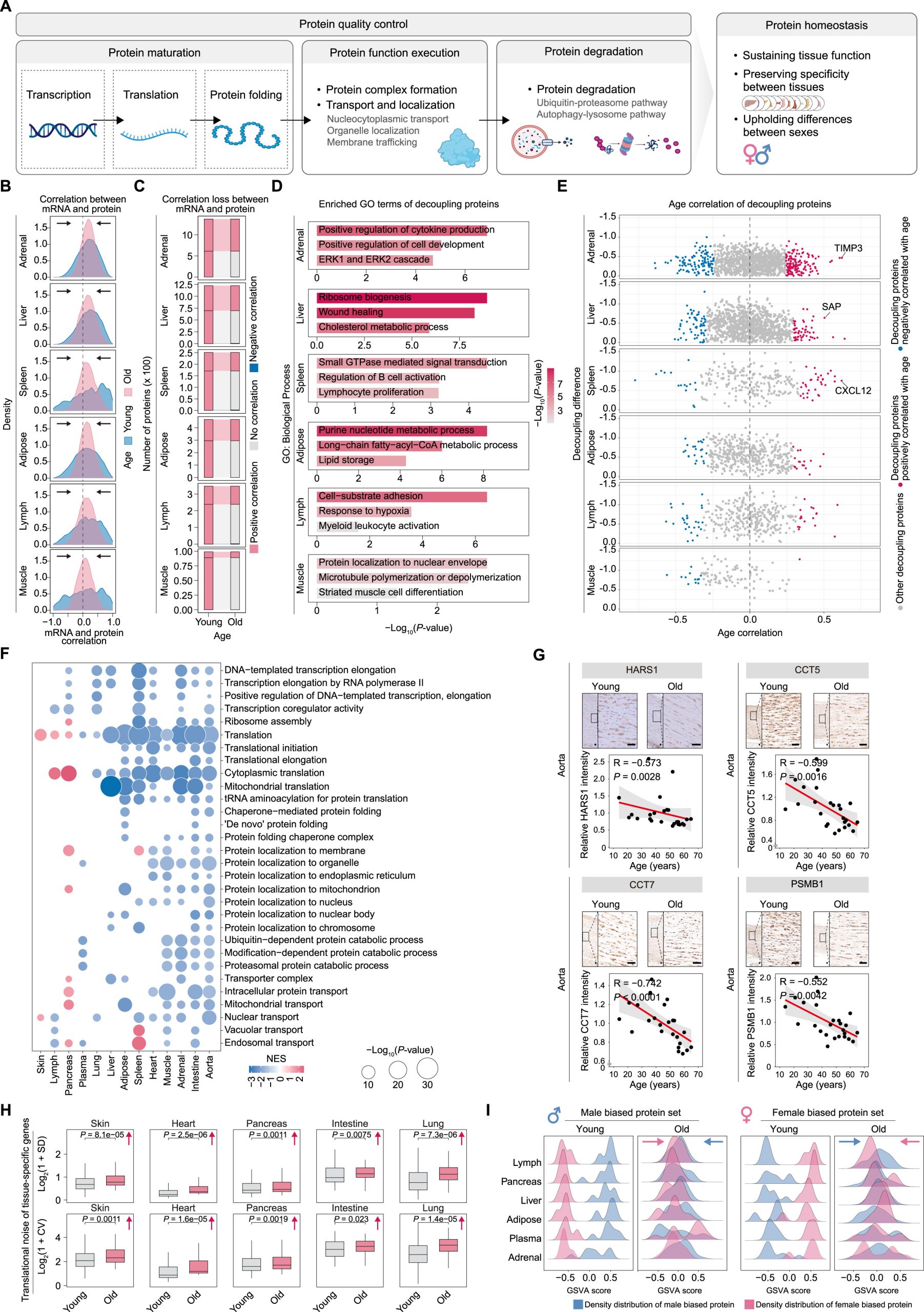
图3 Aging-related mRNA-protein decoupling and proteostasis loss
02
蛋白质稳态的衰退

图4 Aging-related mRNA-protein decoupling and proteostasis loss
03
衰老的组织特异性
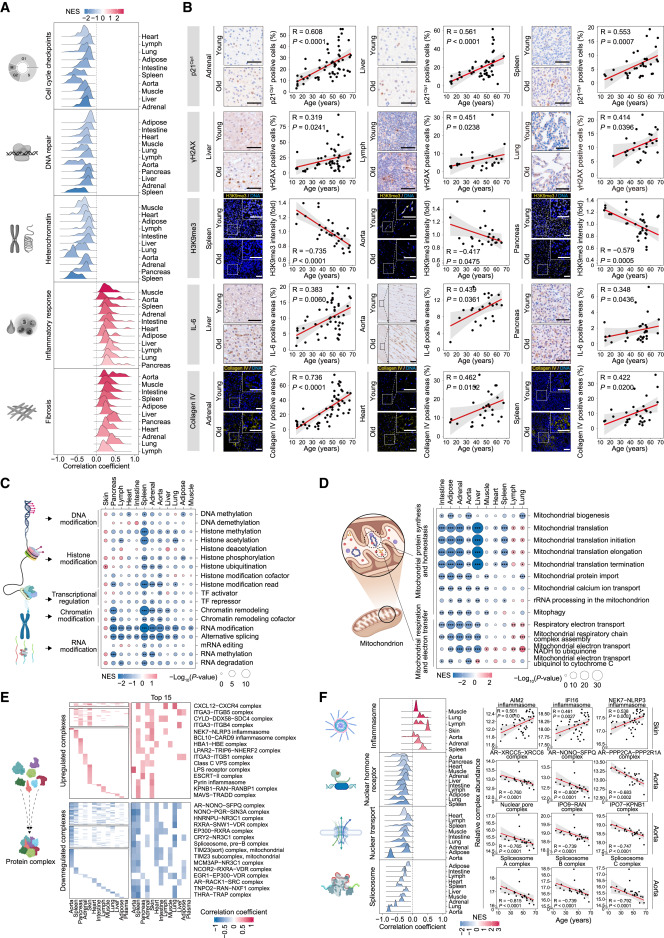
图5 Shared aging proteomic signatures converge on core pathways across tissues
04
衰老标记物的发现
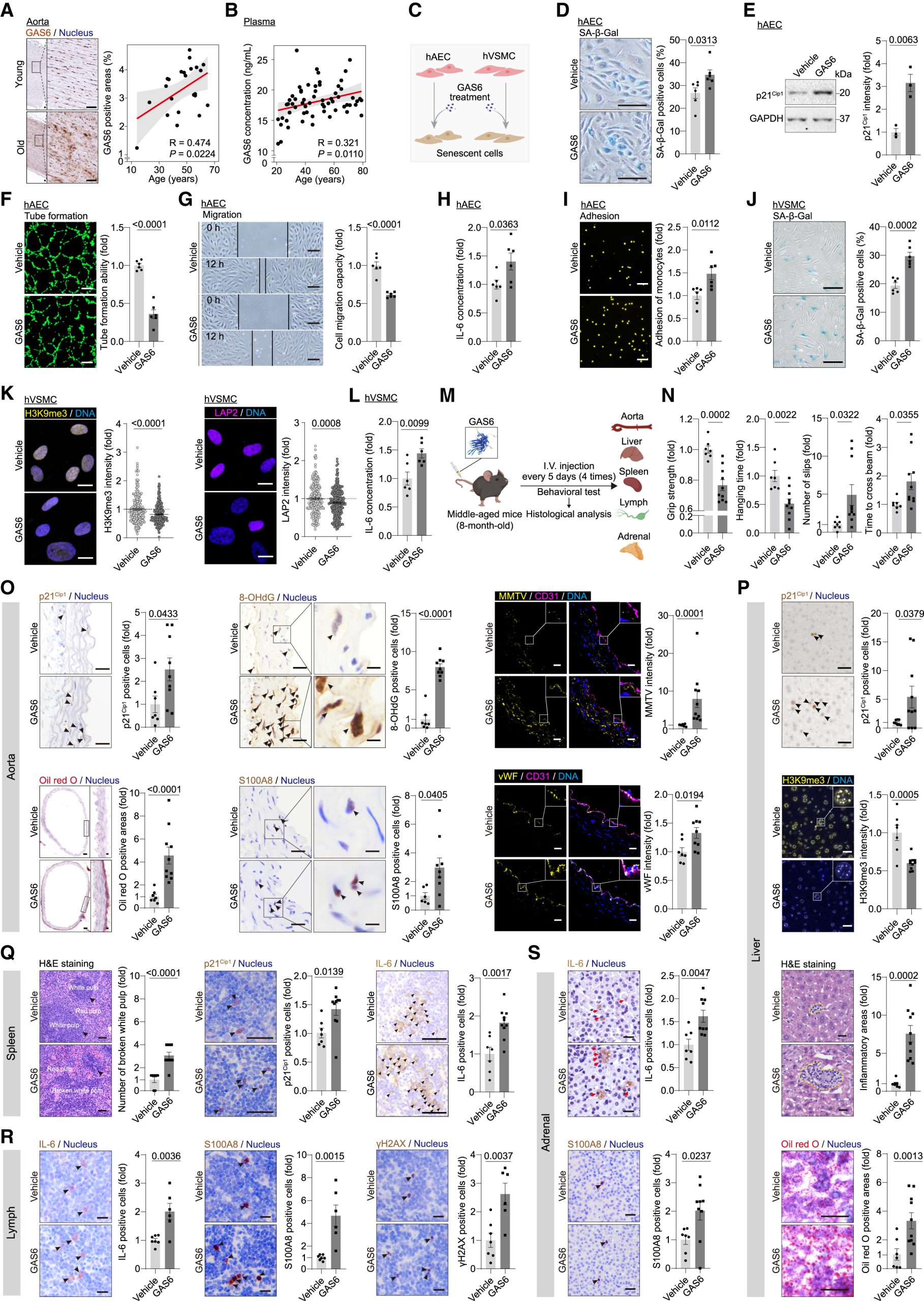
图6 GAS6 promotes human endothelial senescence and mouse multi-organ aging
05
小结
免责声明:本篇文章由人工智能(ChatGPT 5)撰写,内容基于相关文献、研究成果和现有科技进展的综合分析。虽然我们力求确保文章信息的准确性和可靠性,但由于AI生成内容的局限性,本文的观点和见解仅供参考。读者在应用或引用本文内容时,请自行核实相关信息和数据的有效性。我们不对任何因使用本文内容所导致的直接或间接损失承担责任。
人,就像一部精密的交响乐,每个音符(蛋白质)都在配合演奏生命的乐章。年轻时,乐队配合无间,旋律流畅;可随着岁月的流逝,有的乐器开始跑调,有的甚至沉默不奏——这便是衰老。2025年7月25日,Cell期刊发表的一项题为"Comprehensive human proteome profiles across a 50-year lifespan reveal aging trajectories and signatures"的研究,就像一位细心的指挥家,重新审视这部生命交响曲,找到了音符错乱的原因。它不仅让我们窥见衰老背后的分子秘密,也为未来如何“调音”延缓衰老提供了灵感。或许,有一天,我们能让这首生命的乐章演奏得更久、更动听。

图1 文章截图
该研究揭示了衰老过程中蛋白质的变化、衰老标记物的识别,进一步推动了我们对衰老和相关疾病的认知。今天,让我们一起走进这项研究,了解蛋白质组学如何揭示衰老奥秘,并为未来的疾病预防和治疗提供新线索。这项由中国科学院等多个科研机构联合进行的研究,收集了13种不同人体组织的516个样本,涵盖了从14岁到68岁的个体。研究团队利用先进的质谱技术对这些样本进行了蛋白质的定量分析,结合转录组学数据,揭示了不同年龄段、不同组织中的蛋白质变化。通过这一方法,研究人员建立了一个跨越50年的人类衰老蛋白质组图谱,全面展示了衰老过程中的蛋白质变化。

图2 A multi-tissue proteomic atlas outlines age- and tissue-associated protein features
01
蛋白质与转录组脱钩

图3 Aging-related mRNA-protein decoupling and proteostasis loss
02
蛋白质稳态的衰退

图4 Aging-related mRNA-protein decoupling and proteostasis loss
03
衰老的组织特异性

图5 Shared aging proteomic signatures converge on core pathways across tissues
04
衰老标记物的发现

图6 GAS6 promotes human endothelial senescence and mouse multi-organ aging
05
小结
免责声明:本篇文章由人工智能(ChatGPT 5)撰写,内容基于相关文献、研究成果和现有科技进展的综合分析。虽然我们力求确保文章信息的准确性和可靠性,但由于AI生成内容的局限性,本文的观点和见解仅供参考。读者在应用或引用本文内容时,请自行核实相关信息和数据的有效性。我们不对任何因使用本文内容所导致的直接或间接损失承担责任。