2025年7月15日,全球神经退行性蛋白组学联盟(Global Neurodegeneration Proteomics Consortium, GNPC)在《自然·医学》(Nature Medicine)和《自然·衰老》(Nature Aging)上发表系列研究,标志着神经退行性疾病研究的一项重大突破。该研究基于迄今为止最大规模的神经退行性疾病相关蛋白质组数据集,首次系统构建了阿尔茨海默病(Alzheimer’s disease, AD)、帕金森病(Parkinson’s disease, PD)、额颞叶痴呆(Frontotemporal dementia, FTD)以及肌萎缩侧索硬化症(Amyotrophic lateral sclerosis, ALS)的全蛋白质组分子图谱。

1. (World View)全球合作是解码阿尔茨海默病的关键

2. (News & Views)基于多组学分析揭示神经退行疾病的治疗靶点

3.(Comment)衰老过程中蛋白质稳态失衡的跨组织传播机制

4.(Article)全球神经退化蛋白质组联盟(GNPC):常见神经退行性疾病与衰老的生物标志物与药物靶点发现
全球有超过5700万神经退行性疾病患者,这一数字预计每20年翻一番。面对日益加重的疾病负担,科学家们通过全球合作取得了重要突破。由23个机构组成的"全球神经退行蛋白质组学联盟"(GNPC)建立了世界上最大的蛋白质组学数据库,包含3.5万份生物样本和2.5亿条蛋白质数据,为研究阿尔茨海默病(AD)、帕金森病(PD)、额颞叶痴呆(FTD)和肌萎缩侧索硬化症(ALS)提供了宝贵资源。
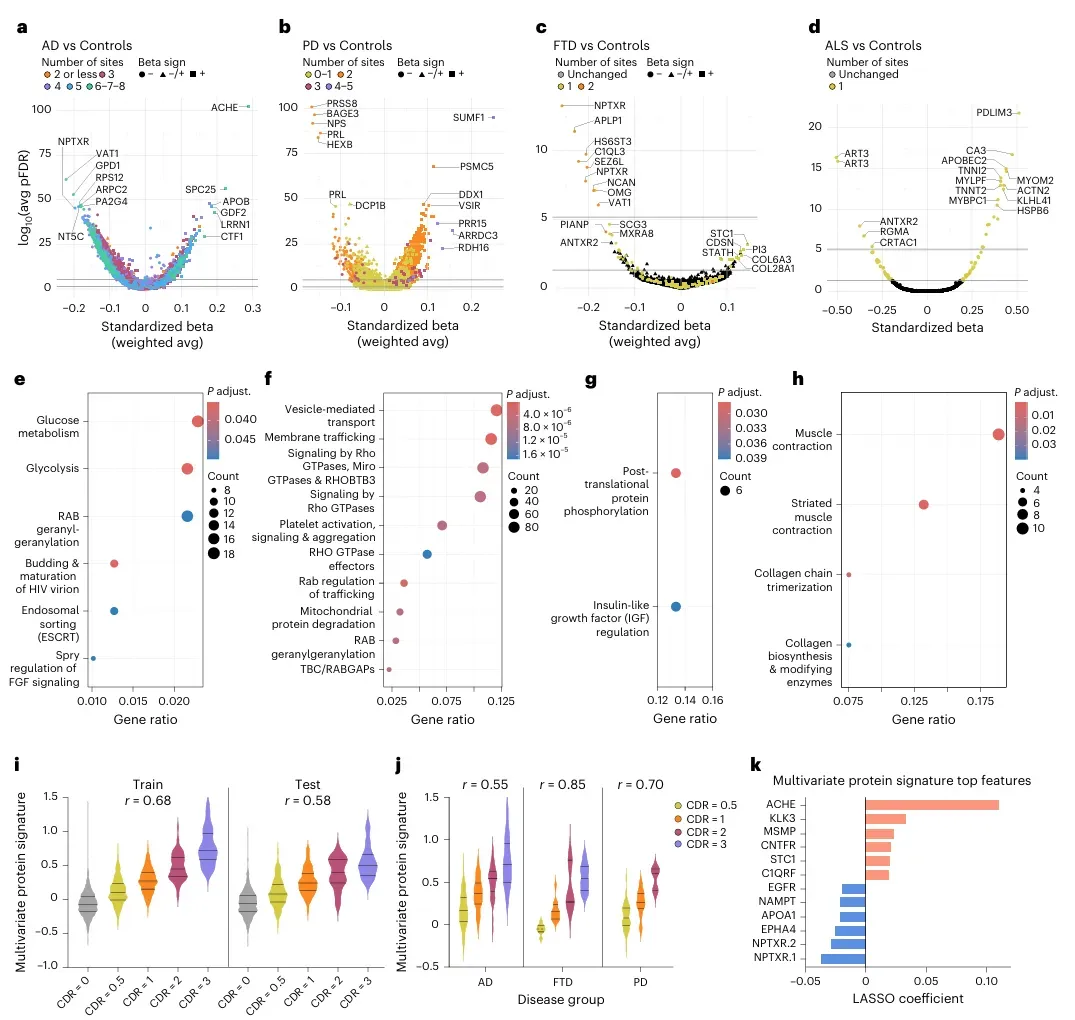
研究发现,不同疾病具有独特的蛋白质特征。AD患者血浆中27种蛋白显著升高(如ACHE、SPC25),130种降低(如VAT1、GPD1);PD患者40种蛋白升高(如SUMF1、PRR15),15种降低;FTD患者9种关键蛋白下降;ALS患者则出现82种肌肉相关蛋白异常。科学家们还构建了一个包含256种蛋白的疾病严重程度预测模型,准确率达到0.58-0.68。
研究还发现,不同神经退行性疾病与特定器官衰老密切相关。脑部衰老与AD和FTD风险显著相关(风险增加26%-33%),肌肉衰老则与PD风险升高12%有关。这些发现为理解神经退行性疾病的全身性影响提供了新视角。
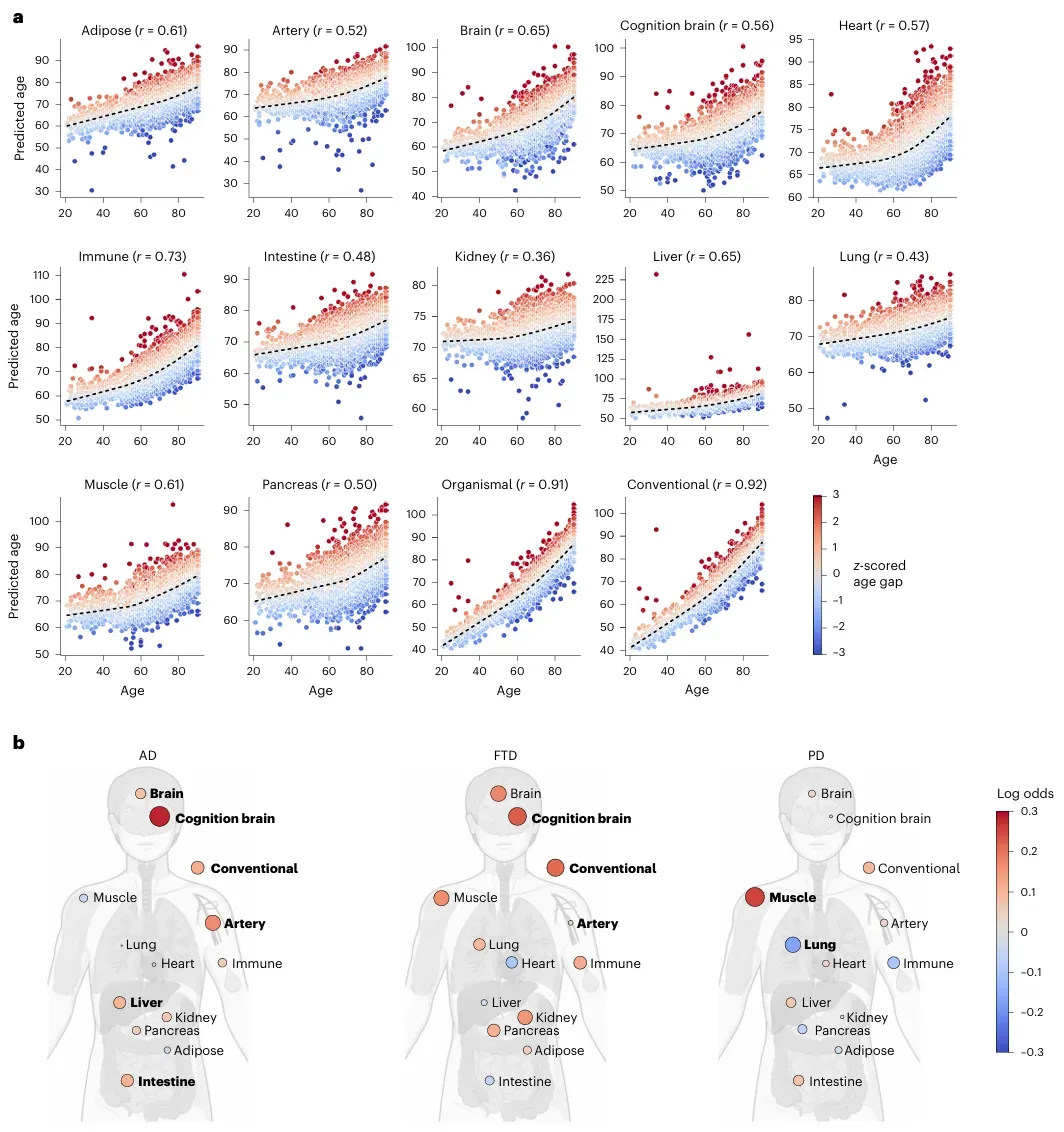
这项跨越国界的大型合作研究,通过海量数据揭示了神经退行性疾病的分子特征,为未来开发更精准的诊断方法和治疗靶点奠定了重要基础。
5.(Article)额颞叶痴呆与阿尔茨海默病及帕金森病中的共有与疾病特异性通路

6.(Article)认知障碍与衰老中的脑脊液-血浆蛋白平衡紊乱
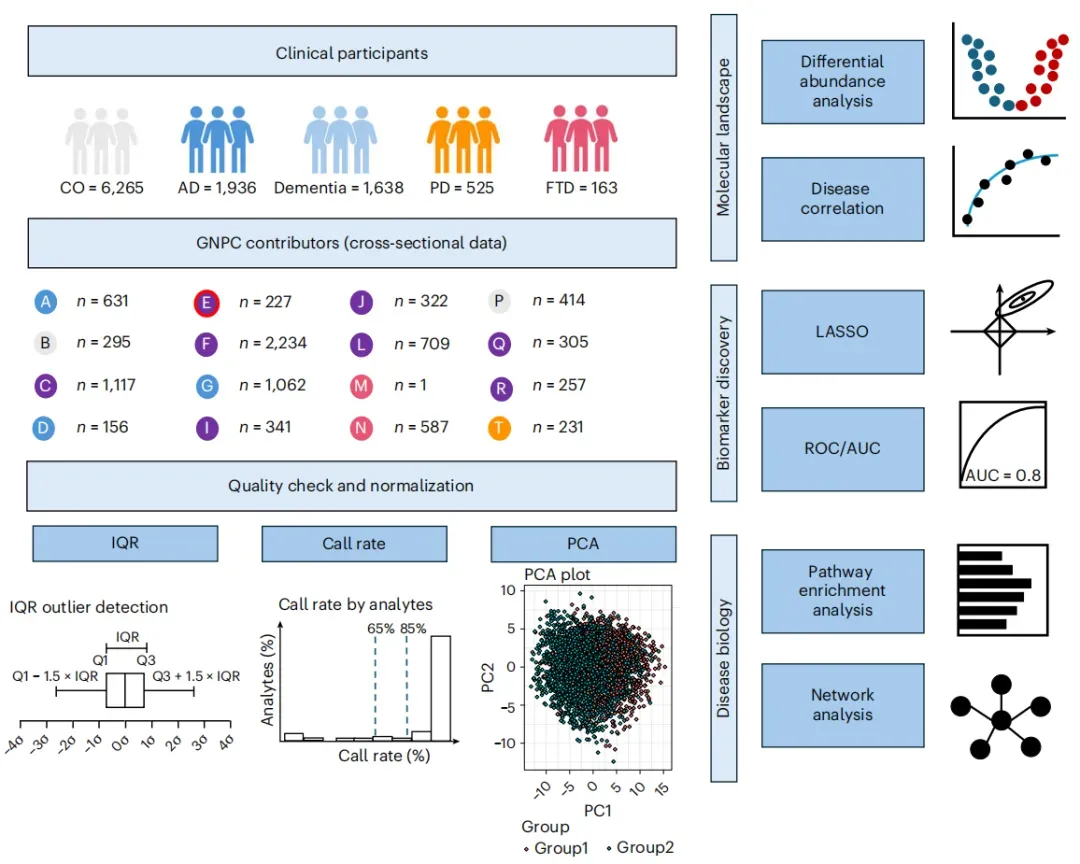
最新研究通过分析来自GNPC等机构的2171名老年人的脑脊液(CSF)和血浆样本,首次系统揭示了脑屏障系统在衰老和神经退行性疾病中的关键作用。脑屏障(包括脉络丛、脑膜和脑血管)像一道智能关卡,精准调控血液与脑脊液之间的物质交换,维持大脑环境的稳定。
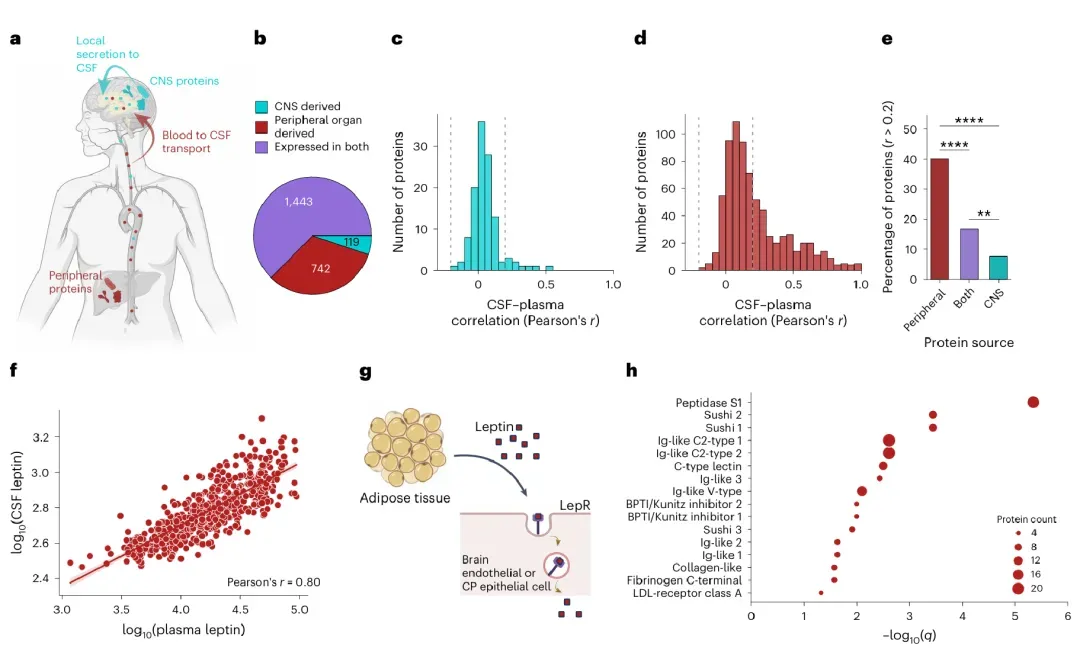
研究发现,部分蛋白质在脑脊液和血浆中的水平高度相关,可能依赖脑屏障的主动转运机制。在健康人群中,848种蛋白的脑脊液/血浆比值会随年龄增长而升高,包括补体蛋白、凝血因子和神经退行相关蛋白;而64种蛋白的比值则下降,表明脑屏障对不同物质的调控具有高度选择性。
特别引人注目的是,某些外周来源的蛋白(如DCUN1D1、MFGE8和VEGFA)在脑脊液中比例升高时,与更好的认知功能相关,提示它们可能具有神经保护作用。这一发现为理解大脑衰老和神经退行性疾病的机制提供了新视角,并可能为未来开发能穿透血脑屏障的神经保护药物提供关键靶点。
该研究不仅揭示了脑屏障在衰老过程中的动态变化规律,也为探索如何通过调控蛋白质转运来延缓认知衰退提供了重要线索。
https://www.nature.com/articles/s41591-025-03831-3

7.(Article)APOE ε4携带者在多种神经退行性疾病中共享免疫相关蛋白质组学变化
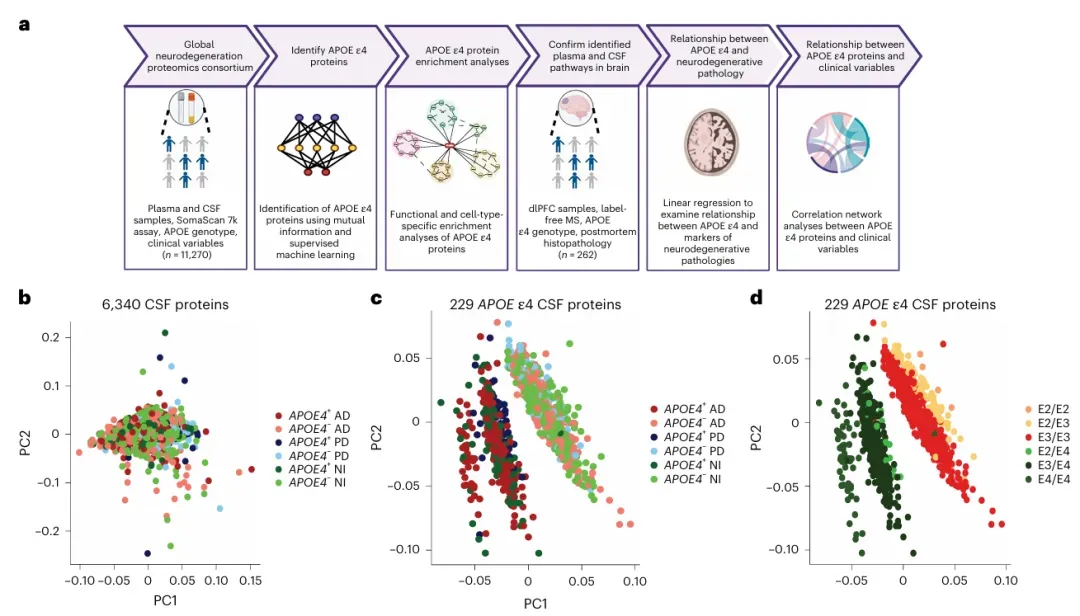
最新研究发现,被称为"阿尔茨海默病最强风险基因"的APOE ε4,可能通过影响免疫系统,成为多种脑部疾病的共同推手。通过分析GNPC的11,270份脑脊液和血液样本,首次揭示了这个基因在阿尔茨海默病、帕金森病、额颞叶痴呆等疾病中的关键作用。
研究团队发现,携带APOE ε4基因的人群,无论是否患病,体内都存在着一个共有的蛋白质特征。这个特征涉及炎症反应、免疫细胞(如单核细胞、T细胞)活性增强等变化,且在不同疾病中表现一致。更惊人的是,这些变化独立于各类疾病特有的病理特征,如阿尔茨海默病的amyloid-β plaques、帕金森病的α-synuclein等。
通过对262例大脑组织的验证分析,科学家确认这一免疫特征同样存在于脑部前额叶皮层。研究还发现,虽然APOE ε4基因会系统性改变蛋白质组成,但最终是否发病还受高血压、吸烟等环境因素影响,解释了为何有些携带者终身不发病。
这一突破性发现不仅重新定义了APOE ε4基因的角色——从单纯的"风险标记"升级为"免疫调控开关",更为早期诊断和精准治疗提供了新思路。未来,基于这一特征的血液检测可能帮助预测多种脑部疾病风险,而调节相关免疫通路或将成为预防神经退行的新策略。
https://www.nature.com/articles/s41591-025-03835-z

总 结
GNPC蛋白质组学数据集技术的进步和国际合作的深化,为神经退行性疾病的早期诊断和治疗带来了新的思路,也为开发精准医疗策略奠定了基础。未来十年,我们或许将迎来神经退行性疾病治疗的黄金时代。
声明:本文内容基于期刊公开信息整理,中文解读及科普文字由多个AI 助手生成,旨在帮助大众快速理解前沿研究,不构成任何专业建议或诊断依据。如需实验或临床应用,请以原始文献与专业人士意见为准。

2025年7月15日,全球神经退行性蛋白组学联盟(Global Neurodegeneration Proteomics Consortium, GNPC)在《自然·医学》(Nature Medicine)和《自然·衰老》(Nature Aging)上发表系列研究,标志着神经退行性疾病研究的一项重大突破。该研究基于迄今为止最大规模的神经退行性疾病相关蛋白质组数据集,首次系统构建了阿尔茨海默病(Alzheimer’s disease, AD)、帕金森病(Parkinson’s disease, PD)、额颞叶痴呆(Frontotemporal dementia, FTD)以及肌萎缩侧索硬化症(Amyotrophic lateral sclerosis, ALS)的全蛋白质组分子图谱。

1. (World View)全球合作是解码阿尔茨海默病的关键

2. (News & Views)基于多组学分析揭示神经退行疾病的治疗靶点

3.(Comment)衰老过程中蛋白质稳态失衡的跨组织传播机制

4.(Article)全球神经退化蛋白质组联盟(GNPC):常见神经退行性疾病与衰老的生物标志物与药物靶点发现
全球有超过5700万神经退行性疾病患者,这一数字预计每20年翻一番。面对日益加重的疾病负担,科学家们通过全球合作取得了重要突破。由23个机构组成的"全球神经退行蛋白质组学联盟"(GNPC)建立了世界上最大的蛋白质组学数据库,包含3.5万份生物样本和2.5亿条蛋白质数据,为研究阿尔茨海默病(AD)、帕金森病(PD)、额颞叶痴呆(FTD)和肌萎缩侧索硬化症(ALS)提供了宝贵资源。

研究发现,不同疾病具有独特的蛋白质特征。AD患者血浆中27种蛋白显著升高(如ACHE、SPC25),130种降低(如VAT1、GPD1);PD患者40种蛋白升高(如SUMF1、PRR15),15种降低;FTD患者9种关键蛋白下降;ALS患者则出现82种肌肉相关蛋白异常。科学家们还构建了一个包含256种蛋白的疾病严重程度预测模型,准确率达到0.58-0.68。

研究还发现,不同神经退行性疾病与特定器官衰老密切相关。脑部衰老与AD和FTD风险显著相关(风险增加26%-33%),肌肉衰老则与PD风险升高12%有关。这些发现为理解神经退行性疾病的全身性影响提供了新视角。

这项跨越国界的大型合作研究,通过海量数据揭示了神经退行性疾病的分子特征,为未来开发更精准的诊断方法和治疗靶点奠定了重要基础。
5.(Article)额颞叶痴呆与阿尔茨海默病及帕金森病中的共有与疾病特异性通路


6.(Article)认知障碍与衰老中的脑脊液-血浆蛋白平衡紊乱
最新研究通过分析来自GNPC等机构的2171名老年人的脑脊液(CSF)和血浆样本,首次系统揭示了脑屏障系统在衰老和神经退行性疾病中的关键作用。脑屏障(包括脉络丛、脑膜和脑血管)像一道智能关卡,精准调控血液与脑脊液之间的物质交换,维持大脑环境的稳定。
研究发现,部分蛋白质在脑脊液和血浆中的水平高度相关,可能依赖脑屏障的主动转运机制。在健康人群中,848种蛋白的脑脊液/血浆比值会随年龄增长而升高,包括补体蛋白、凝血因子和神经退行相关蛋白;而64种蛋白的比值则下降,表明脑屏障对不同物质的调控具有高度选择性。
特别引人注目的是,某些外周来源的蛋白(如DCUN1D1、MFGE8和VEGFA)在脑脊液中比例升高时,与更好的认知功能相关,提示它们可能具有神经保护作用。这一发现为理解大脑衰老和神经退行性疾病的机制提供了新视角,并可能为未来开发能穿透血脑屏障的神经保护药物提供关键靶点。
该研究不仅揭示了脑屏障在衰老过程中的动态变化规律,也为探索如何通过调控蛋白质转运来延缓认知衰退提供了重要线索。
https://www.nature.com/articles/s41591-025-03831-3


7.(Article)APOE ε4携带者在多种神经退行性疾病中共享免疫相关蛋白质组学变化
最新研究发现,被称为"阿尔茨海默病最强风险基因"的APOE ε4,可能通过影响免疫系统,成为多种脑部疾病的共同推手。通过分析GNPC的11,270份脑脊液和血液样本,首次揭示了这个基因在阿尔茨海默病、帕金森病、额颞叶痴呆等疾病中的关键作用。
研究团队发现,携带APOE ε4基因的人群,无论是否患病,体内都存在着一个共有的蛋白质特征。这个特征涉及炎症反应、免疫细胞(如单核细胞、T细胞)活性增强等变化,且在不同疾病中表现一致。更惊人的是,这些变化独立于各类疾病特有的病理特征,如阿尔茨海默病的amyloid-β plaques、帕金森病的α-synuclein等。
通过对262例大脑组织的验证分析,科学家确认这一免疫特征同样存在于脑部前额叶皮层。研究还发现,虽然APOE ε4基因会系统性改变蛋白质组成,但最终是否发病还受高血压、吸烟等环境因素影响,解释了为何有些携带者终身不发病。
这一突破性发现不仅重新定义了APOE ε4基因的角色——从单纯的"风险标记"升级为"免疫调控开关",更为早期诊断和精准治疗提供了新思路。未来,基于这一特征的血液检测可能帮助预测多种脑部疾病风险,而调节相关免疫通路或将成为预防神经退行的新策略。
https://www.nature.com/articles/s41591-025-03835-z


总 结
GNPC蛋白质组学数据集技术的进步和国际合作的深化,为神经退行性疾病的早期诊断和治疗带来了新的思路,也为开发精准医疗策略奠定了基础。未来十年,我们或许将迎来神经退行性疾病治疗的黄金时代。
声明:本文内容基于期刊公开信息整理,中文解读及科普文字由多个AI 助手生成,旨在帮助大众快速理解前沿研究,不构成任何专业建议或诊断依据。如需实验或临床应用,请以原始文献与专业人士意见为准。