研究背景
肝内胆管癌(ICC)作为第二常见的原发性肝癌,其临床治疗面临术后高复发率与预后评估精准度不足的双重挑战。浙江大学医学院附属第一医院等多中心团队联合构建的可解释多模态深度学习模型ICC-PPS,通过整合多维度数据(临床信息、影像组学特征和全切片病理图像等多模态数据),实现了ICC 术后风险分层的突破性提升,并结合多组学验证进一步解释了预测模型的分子生物学意义,提高了模型的可解释性,相关研究成果以“Interpretable multimodal deep learning improves postoperative risk stratification in intrahepatic cholangiocarcinoma in multicentre cohorts”为题发表于npj Digital Medicine,为 ICC 精准诊疗提供了全新范式。

文章标题
研究概要
本研究通过融合临床变量、影像组学特征、全切片病理图像的多模态数据,结合Transformer 架构与多组学验证,构建了兼具高预测精度与生物学可解释性的ICC 术后风险分层模型,解决单模态模型的局限性。
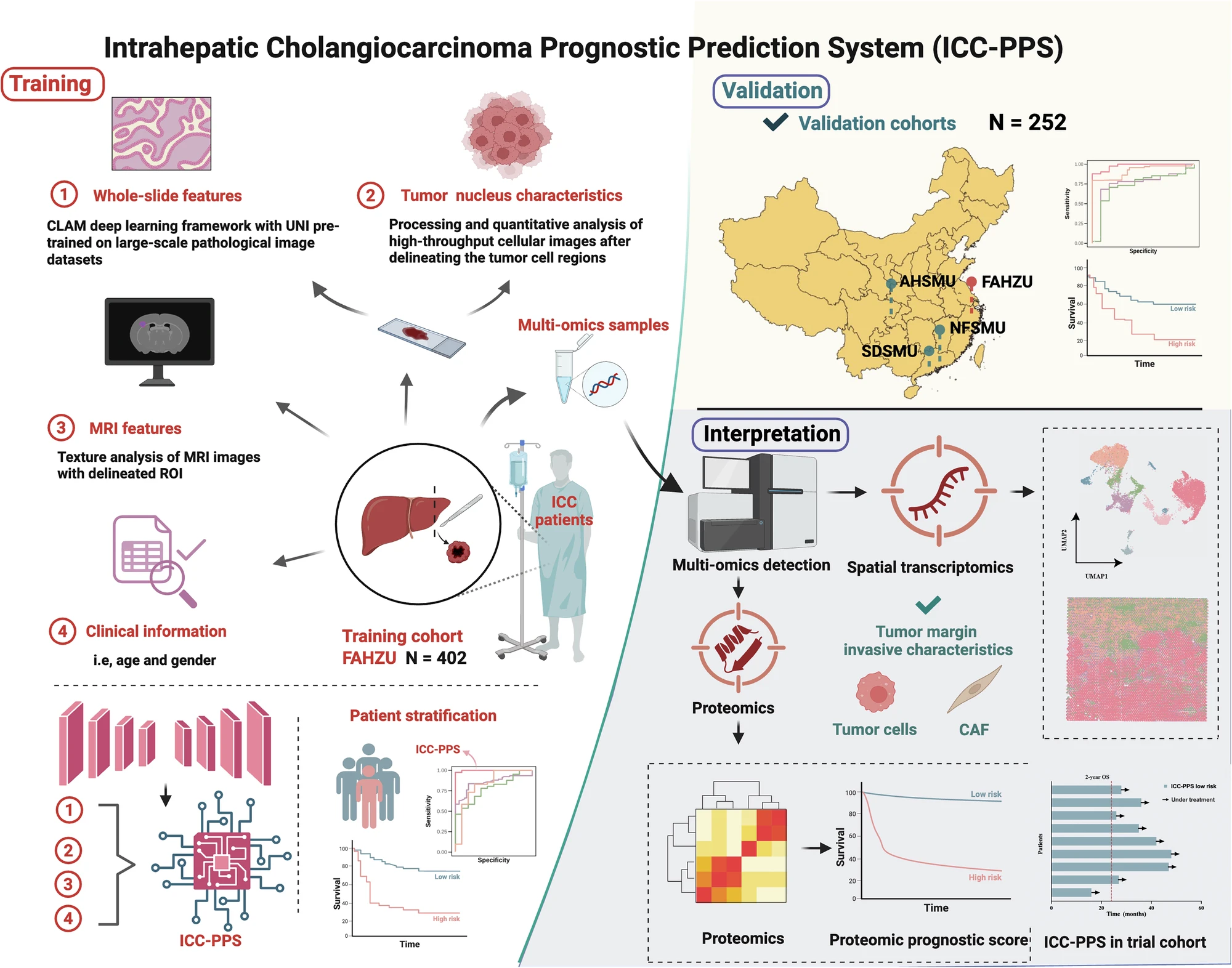
Fig. 1 模型构建工作流程和可解释性思路
队列设计与基线特征
研究最终纳入了2012 年 1 月 - 2022 年 6 月四家医疗中心的 654 例 ICC 术后患者,采用"训练集 + 外部验证集" 的多中心设计,包括下面几个队列,具体纳入过程见Fig. 2:
训练集:浙江大学医学院附属第一医院(FAHZU)402 例,中位生存期 40.0 个月(95% CI:35.1-47.0),含 275 例终点事件。
外部验证集:南方医科大学南方医院(Validation1:NFSMU,151 例)、南方医科大学顺德医院(Validation2:SDSMU,62 例)、西南医科大学附属医院(Validation3:AHSMU,39 例),中位生存期分别为 48.3、41.9、42.1 个月。
前瞻性验证:纳入II 期临床试验(NCT06298968)9 例患者,进一步验证模型临床适用性。
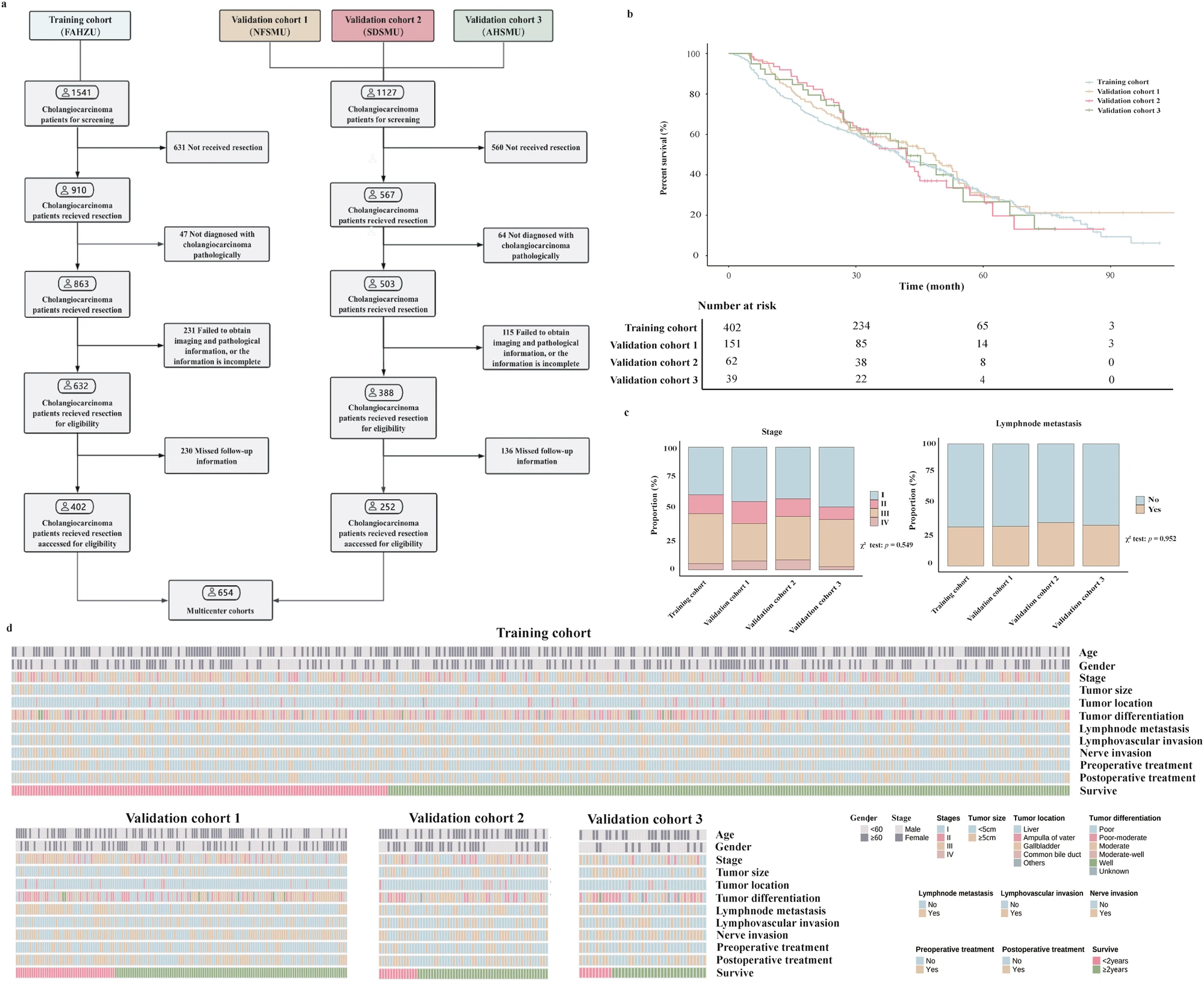
Fig. 2 队列入组情况
关键结果与图表解读
01. 多模态建模与模型性能测试
病理组学特征处理(Fig. 3a-f):对HE染色图像进行图像分割、数据提取和过滤获得病理特征。
影像组学特征:利用PyRadiomics软件从MRI T2加权图像中提取感兴趣区域(ROI)的放射组学特征;经z-score归一化和灰度离散化处理,通过高相关性筛选和FDR校正进行特征选择。
临床特征:获得了11个维度的临床协变量,包括:年龄、性别、TNM分期、肿瘤位置、肿瘤大小、肿瘤分化程度、神经侵犯、淋巴血管侵犯、淋巴结转移、术前治疗、术后治疗。
针对外部验证队列的1 年、2 年、3 年 OS 预测任务,ROC 曲线分析结果表明(Fig. 3k-l):与既往基于注意力机制的CLAM 模型、传统 TNM 分期预测方法相比,本文提出的 ICC-PPS 模型在所有时间节点的预测表现均为最优。
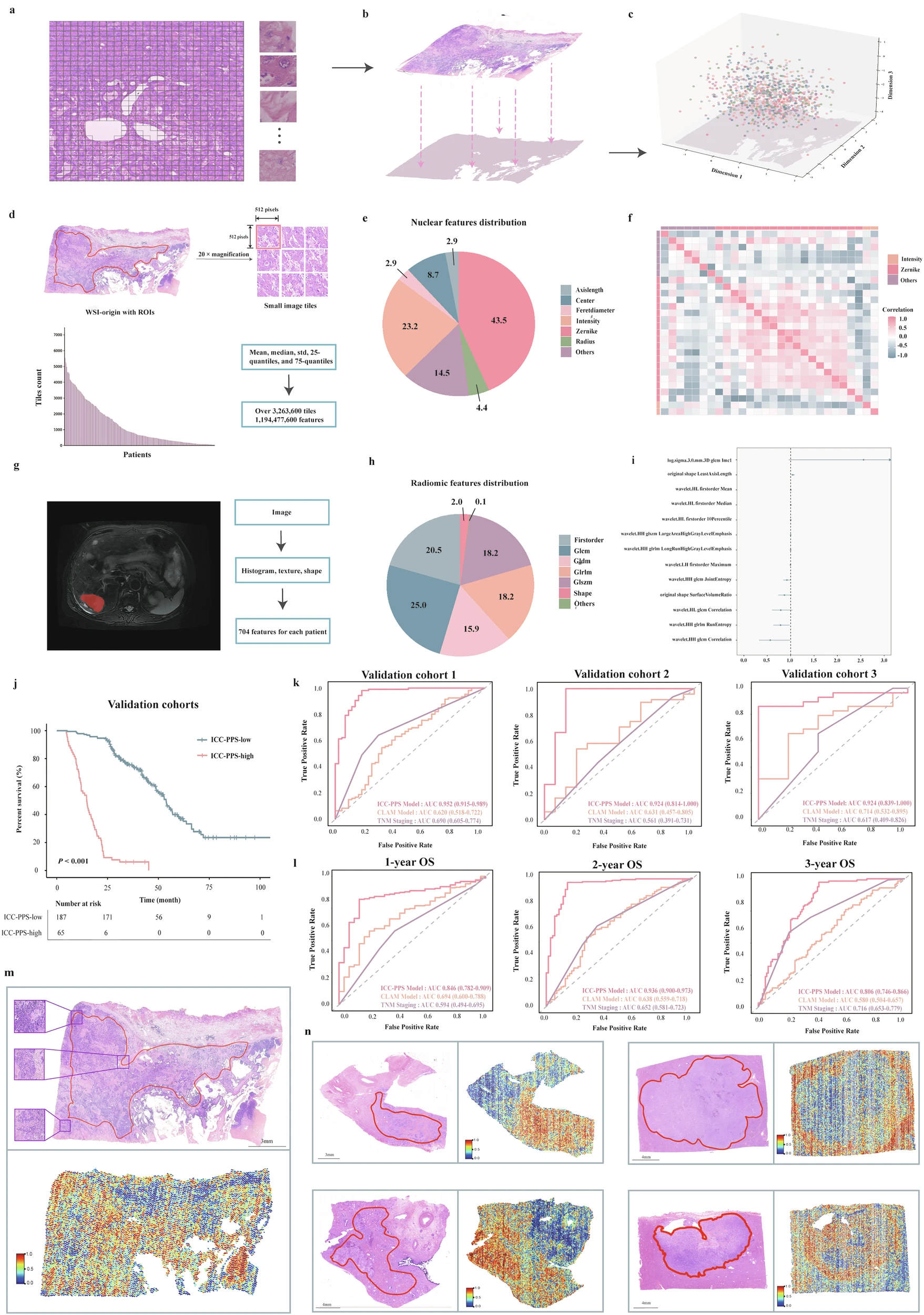
Fig. 3 模态概览与多模态性能比较
02. 空间转录组解析肿瘤边缘侵袭机制
空间转录组学分析证实,高风险患者肿瘤边缘存在增强的增殖活性、EMT表型、异常激活的致癌通路及密集的细胞间通讯,这些分子和细胞特征与肿瘤侵袭性和不良预后相关,从生物学层面解释了ICC-PPS模型的预测机制(Fig. 4)。
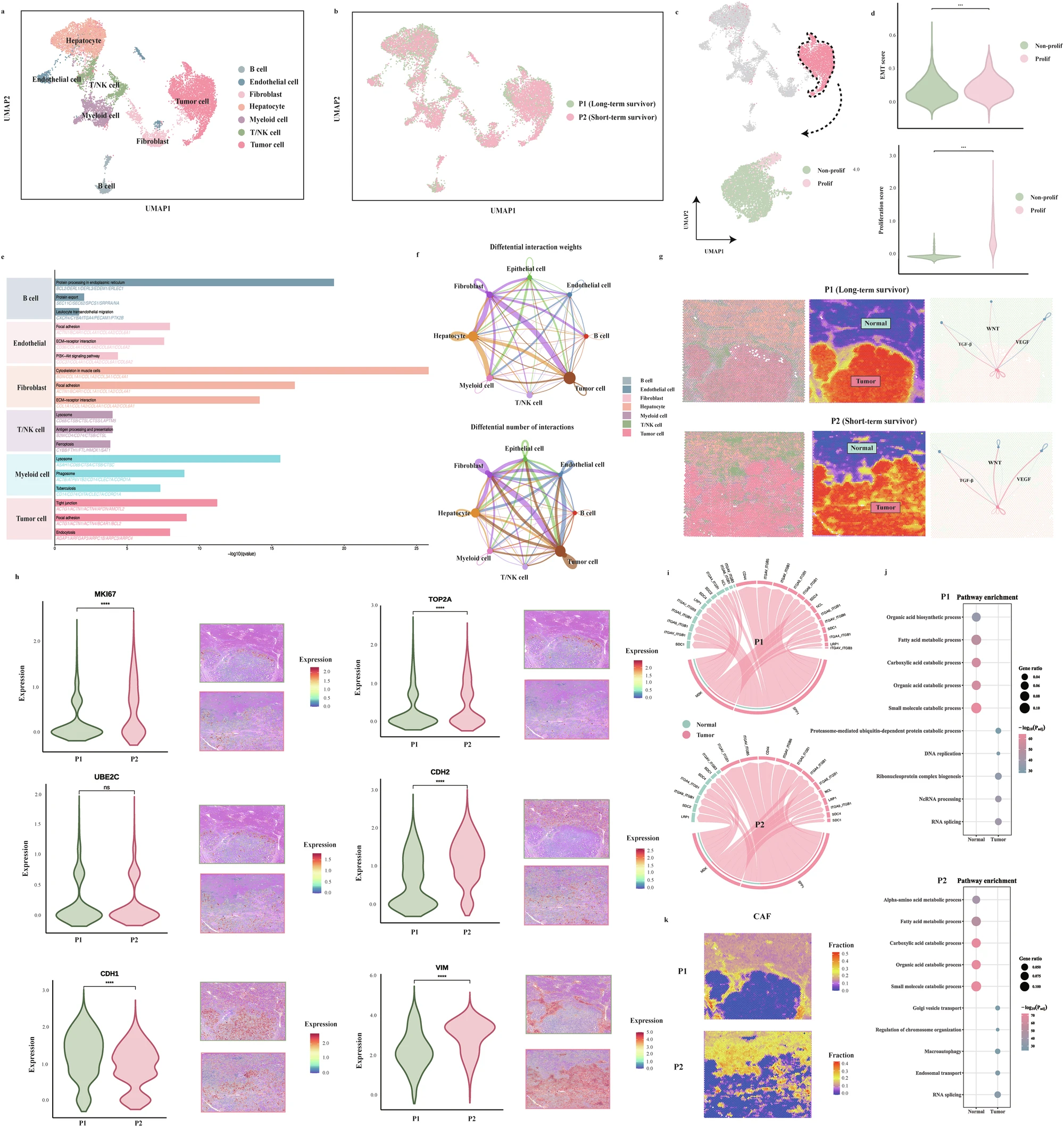
Fig. 4 空间转录组对比高、低风险患者细胞通讯差异
03. 蛋白质组学验证风险相关特征
蛋白质组学分析揭示了高、低风险患者在转移和CAF相关蛋白表达及通路活性上的显著差异,构建的蛋白组ICPS评分具有良好的预后预测价值;前瞻性队列验证进一步证实了ICC-PPS模型的临床适用性,为其转化应用提供了支持(Fig. 5)。
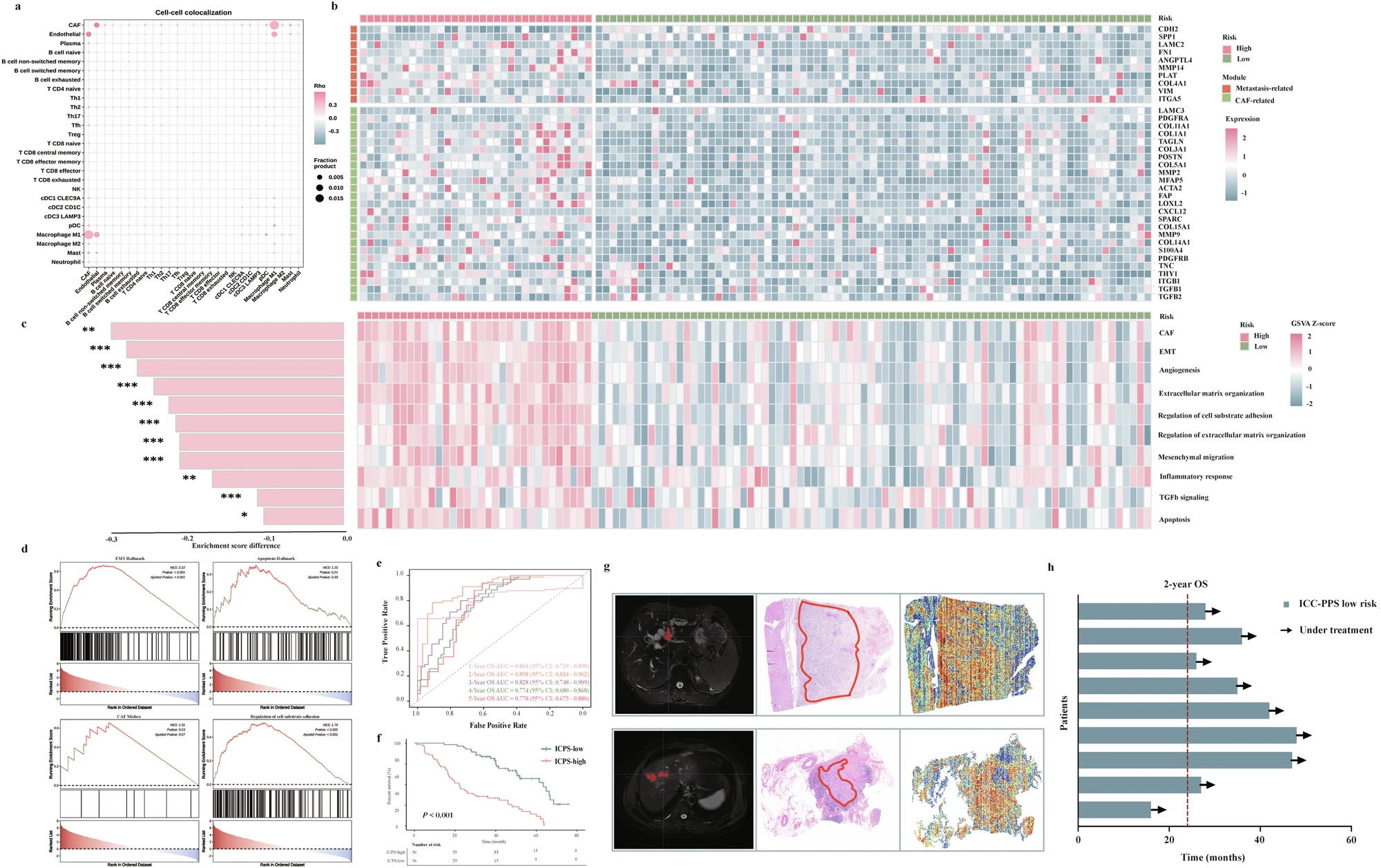
Fig. 5 蛋白组验证和前瞻性队列验证
总结与展望
本研究开发的ICC-PPS通过多模态数据整合和可解释性设计,为ICC患者提供了可靠的术后风险分层工具,研究人员通过多组学数据进一步揭示了肿瘤边缘侵袭性的分子机制,避免了深度学习预测可解释性不足的问题,为生物标志物发现和个体化治疗策略制定提供了依据。
原文链接:https://www.nature.com/articles/s41746-025-02282-x
研究背景
肝内胆管癌(ICC)作为第二常见的原发性肝癌,其临床治疗面临术后高复发率与预后评估精准度不足的双重挑战。浙江大学医学院附属第一医院等多中心团队联合构建的可解释多模态深度学习模型ICC-PPS,通过整合多维度数据(临床信息、影像组学特征和全切片病理图像等多模态数据),实现了ICC 术后风险分层的突破性提升,并结合多组学验证进一步解释了预测模型的分子生物学意义,提高了模型的可解释性,相关研究成果以“Interpretable multimodal deep learning improves postoperative risk stratification in intrahepatic cholangiocarcinoma in multicentre cohorts”为题发表于npj Digital Medicine,为 ICC 精准诊疗提供了全新范式。

文章标题
研究概要
本研究通过融合临床变量、影像组学特征、全切片病理图像的多模态数据,结合Transformer 架构与多组学验证,构建了兼具高预测精度与生物学可解释性的ICC 术后风险分层模型,解决单模态模型的局限性。

Fig. 1 模型构建工作流程和可解释性思路
队列设计与基线特征
研究最终纳入了2012 年 1 月 - 2022 年 6 月四家医疗中心的 654 例 ICC 术后患者,采用"训练集 + 外部验证集" 的多中心设计,包括下面几个队列,具体纳入过程见Fig. 2:
训练集:浙江大学医学院附属第一医院(FAHZU)402 例,中位生存期 40.0 个月(95% CI:35.1-47.0),含 275 例终点事件。
外部验证集:南方医科大学南方医院(Validation1:NFSMU,151 例)、南方医科大学顺德医院(Validation2:SDSMU,62 例)、西南医科大学附属医院(Validation3:AHSMU,39 例),中位生存期分别为 48.3、41.9、42.1 个月。
前瞻性验证:纳入II 期临床试验(NCT06298968)9 例患者,进一步验证模型临床适用性。

Fig. 2 队列入组情况
关键结果与图表解读
01. 多模态建模与模型性能测试
病理组学特征处理(Fig. 3a-f):对HE染色图像进行图像分割、数据提取和过滤获得病理特征。
影像组学特征:利用PyRadiomics软件从MRI T2加权图像中提取感兴趣区域(ROI)的放射组学特征;经z-score归一化和灰度离散化处理,通过高相关性筛选和FDR校正进行特征选择。
临床特征:获得了11个维度的临床协变量,包括:年龄、性别、TNM分期、肿瘤位置、肿瘤大小、肿瘤分化程度、神经侵犯、淋巴血管侵犯、淋巴结转移、术前治疗、术后治疗。
针对外部验证队列的1 年、2 年、3 年 OS 预测任务,ROC 曲线分析结果表明(Fig. 3k-l):与既往基于注意力机制的CLAM 模型、传统 TNM 分期预测方法相比,本文提出的 ICC-PPS 模型在所有时间节点的预测表现均为最优。

Fig. 3 模态概览与多模态性能比较
02. 空间转录组解析肿瘤边缘侵袭机制
空间转录组学分析证实,高风险患者肿瘤边缘存在增强的增殖活性、EMT表型、异常激活的致癌通路及密集的细胞间通讯,这些分子和细胞特征与肿瘤侵袭性和不良预后相关,从生物学层面解释了ICC-PPS模型的预测机制(Fig. 4)。

Fig. 4 空间转录组对比高、低风险患者细胞通讯差异
03. 蛋白质组学验证风险相关特征
蛋白质组学分析揭示了高、低风险患者在转移和CAF相关蛋白表达及通路活性上的显著差异,构建的蛋白组ICPS评分具有良好的预后预测价值;前瞻性队列验证进一步证实了ICC-PPS模型的临床适用性,为其转化应用提供了支持(Fig. 5)。

Fig. 5 蛋白组验证和前瞻性队列验证
总结与展望
本研究开发的ICC-PPS通过多模态数据整合和可解释性设计,为ICC患者提供了可靠的术后风险分层工具,研究人员通过多组学数据进一步揭示了肿瘤边缘侵袭性的分子机制,避免了深度学习预测可解释性不足的问题,为生物标志物发现和个体化治疗策略制定提供了依据。
原文链接:https://www.nature.com/articles/s41746-025-02282-x








