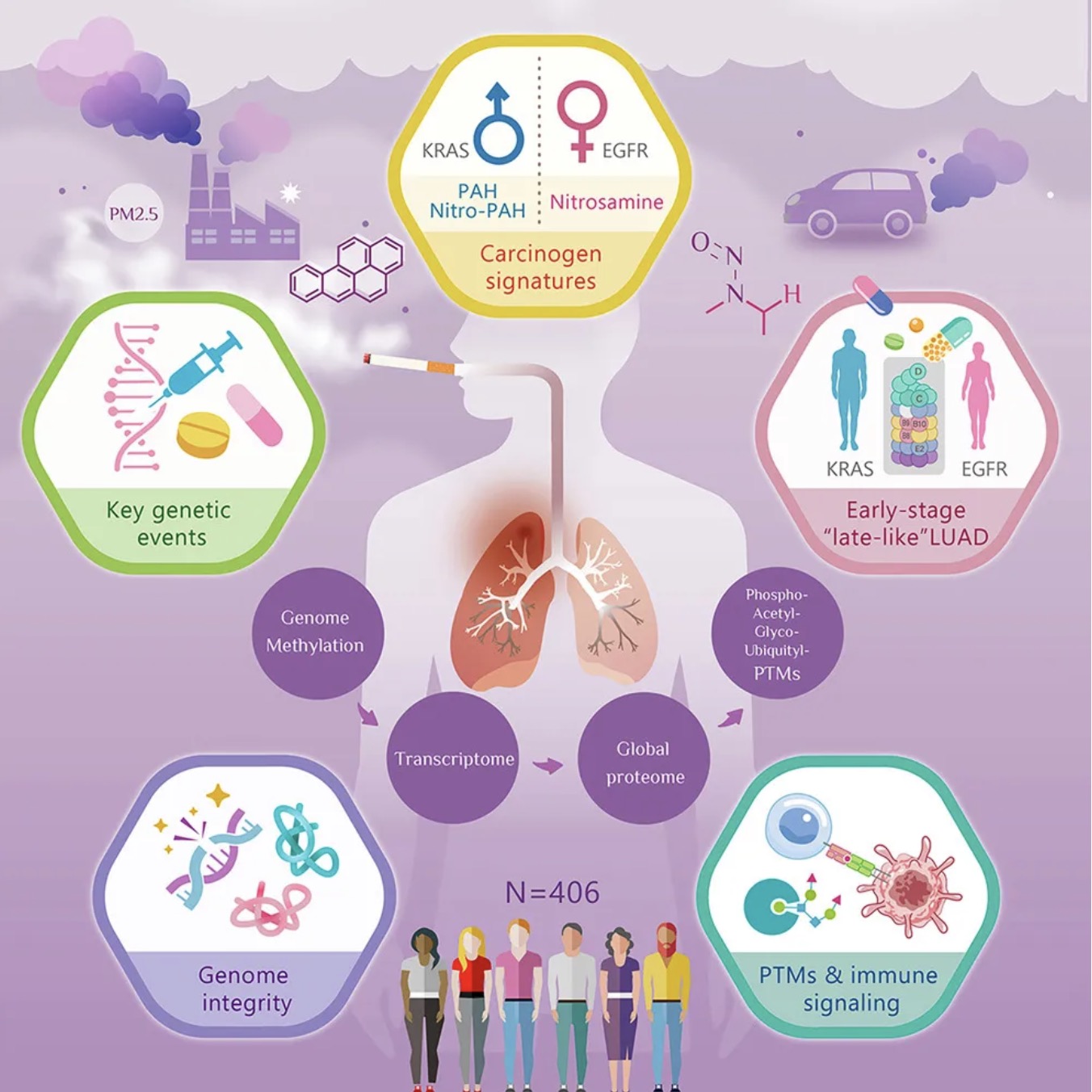
1 (Cancer Cell) 肺腺癌在不同种族和暴露下的综合分析
2 (Circulation) 单细胞多组学鉴定急性心肌炎中具有细胞毒性和迁移性的CD8(+)效应T细胞亚群
3 (Gut) 空间单细胞组学:肝脏疾病的新见解
4 (J Extracell Vesicles) 自发性高血压大鼠的外膜成纤维细胞通过转移骨桥蛋白促进血管重塑
5 (Nat Commun)使用批处理效应减少树(BERT)进行大规模不完整组学数据整合的高性能方法
6 (Nat Commun) vPro-MS 通过非靶向蛋白质组学从患者样本中鉴定人类致病病毒
7 (Nat Protoc) 基于毛细管区带电泳质谱的自上而下蛋白质组学用于蛋白冠的蛋白形式分析
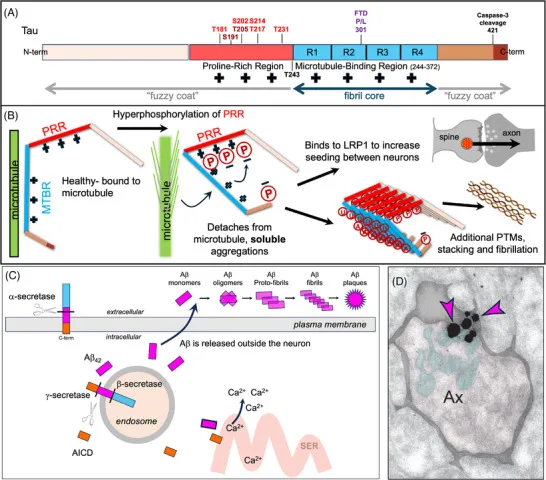
8 (Alzheimers Dement) 阿尔茨海默病中淀粉样蛋白、tau蛋白与炎症病理生理学关系的综合视图

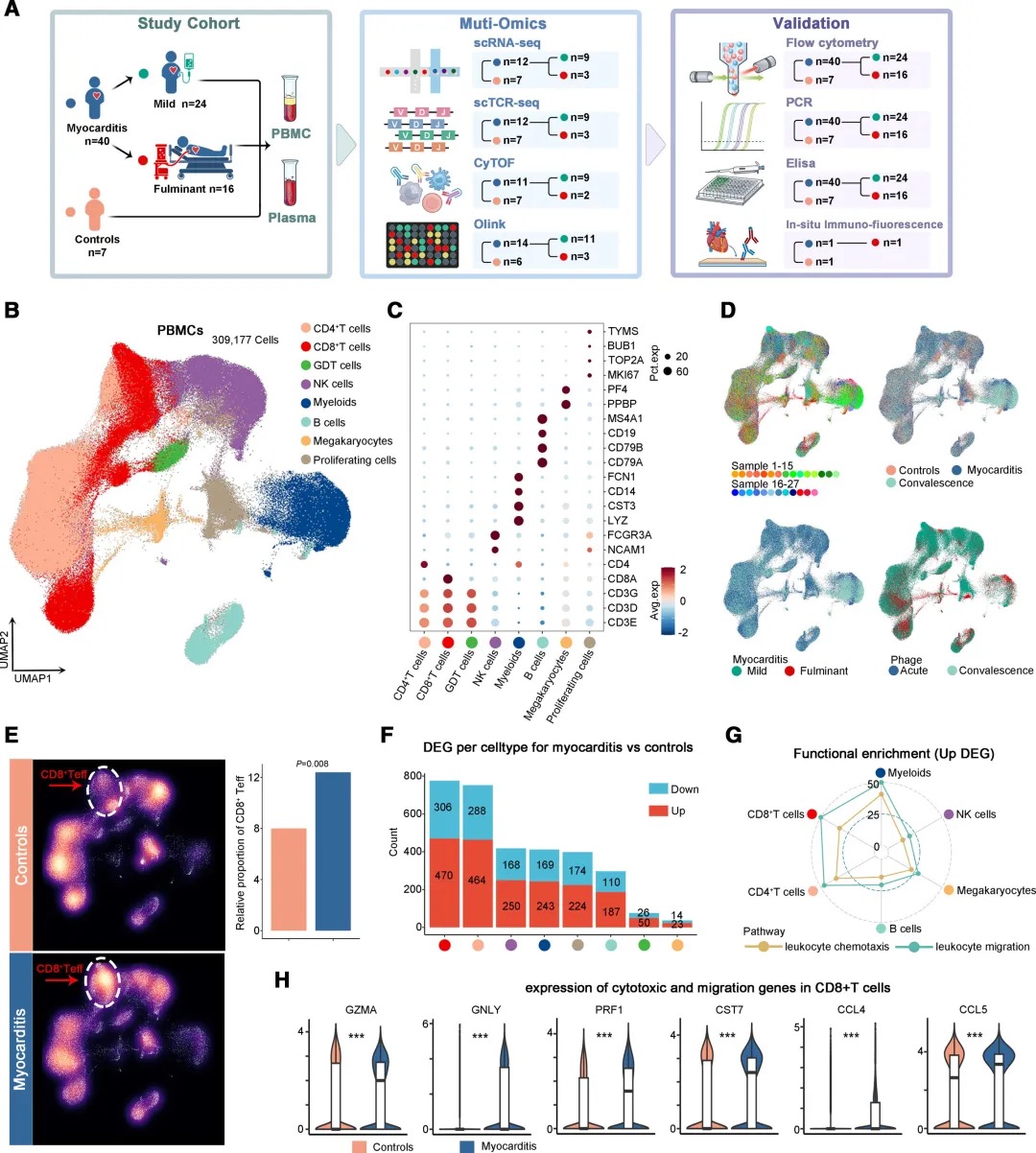
2. (Circulation,IF:35.5)单细胞多组学鉴定急性心肌炎中具有细胞毒性和迁移性的CD8(+)效应T细胞亚群

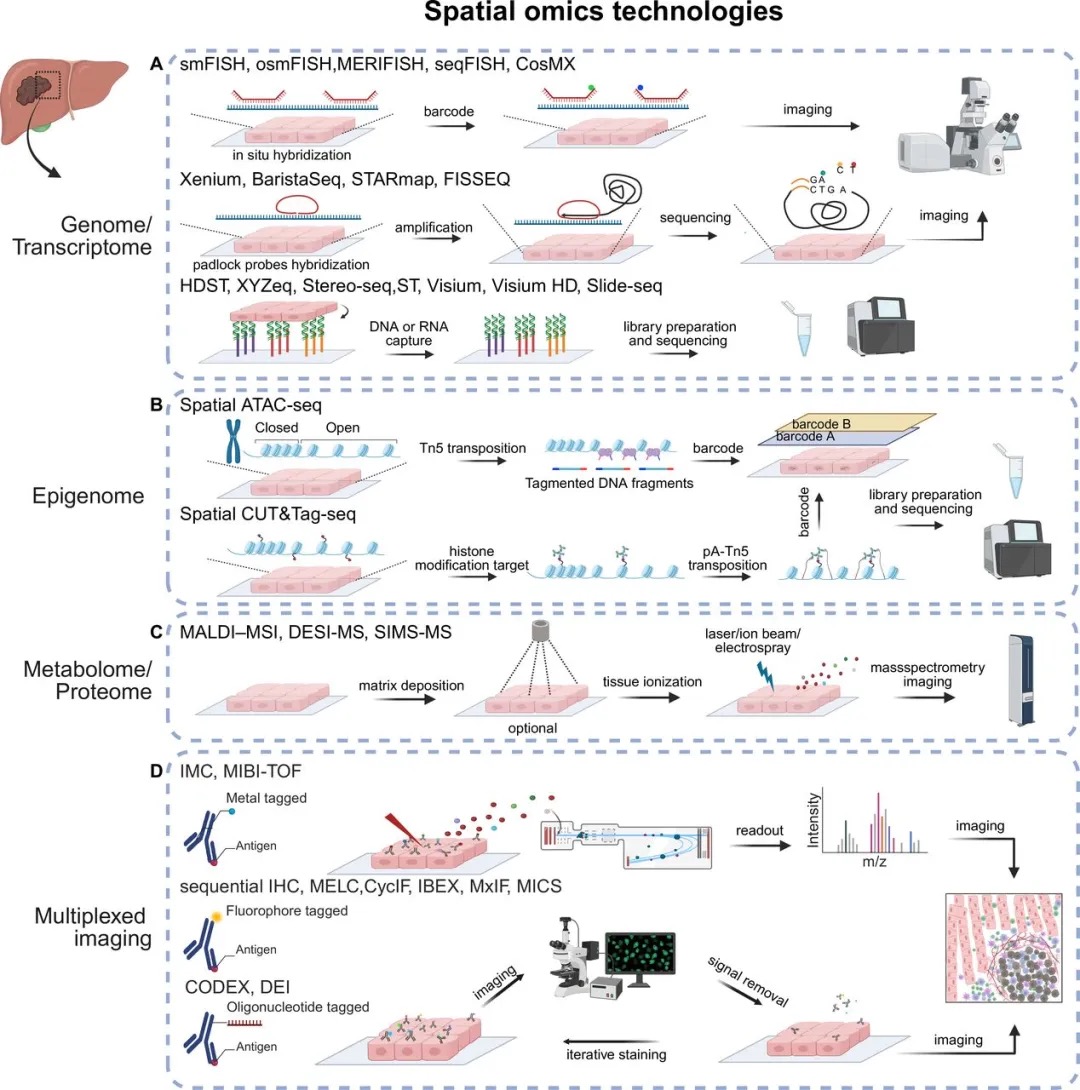
3.(Gut,IF:23.0)空间单细胞组学:肝脏疾病的新见解

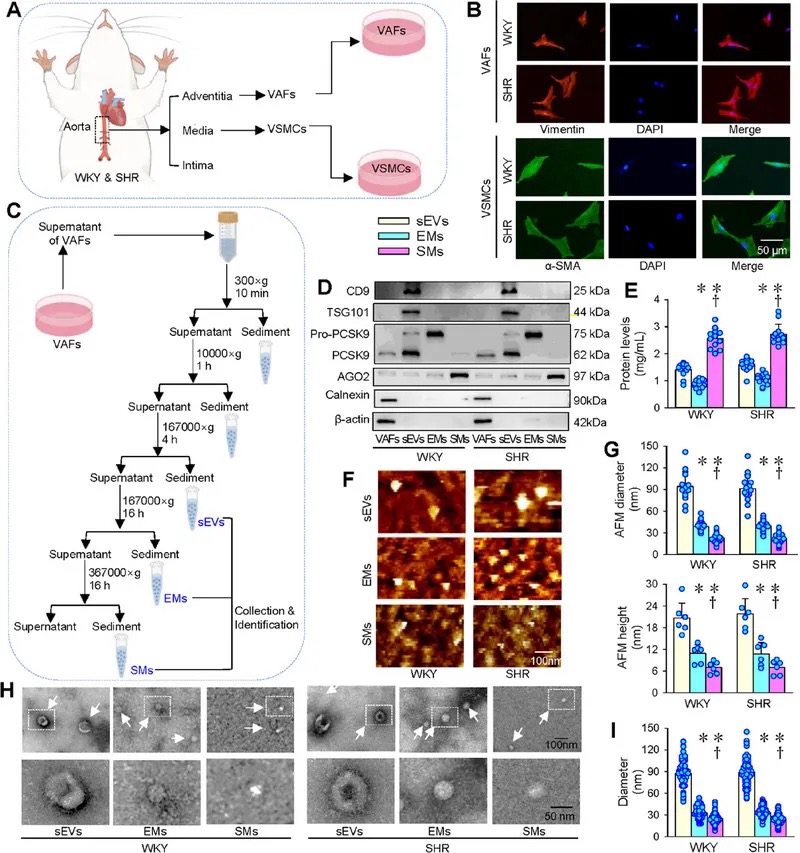
4.(J Extracell Vesicles,IF:15.5)自发性高血压大鼠的外膜成纤维细胞通过转移骨桥蛋白促进血管重塑

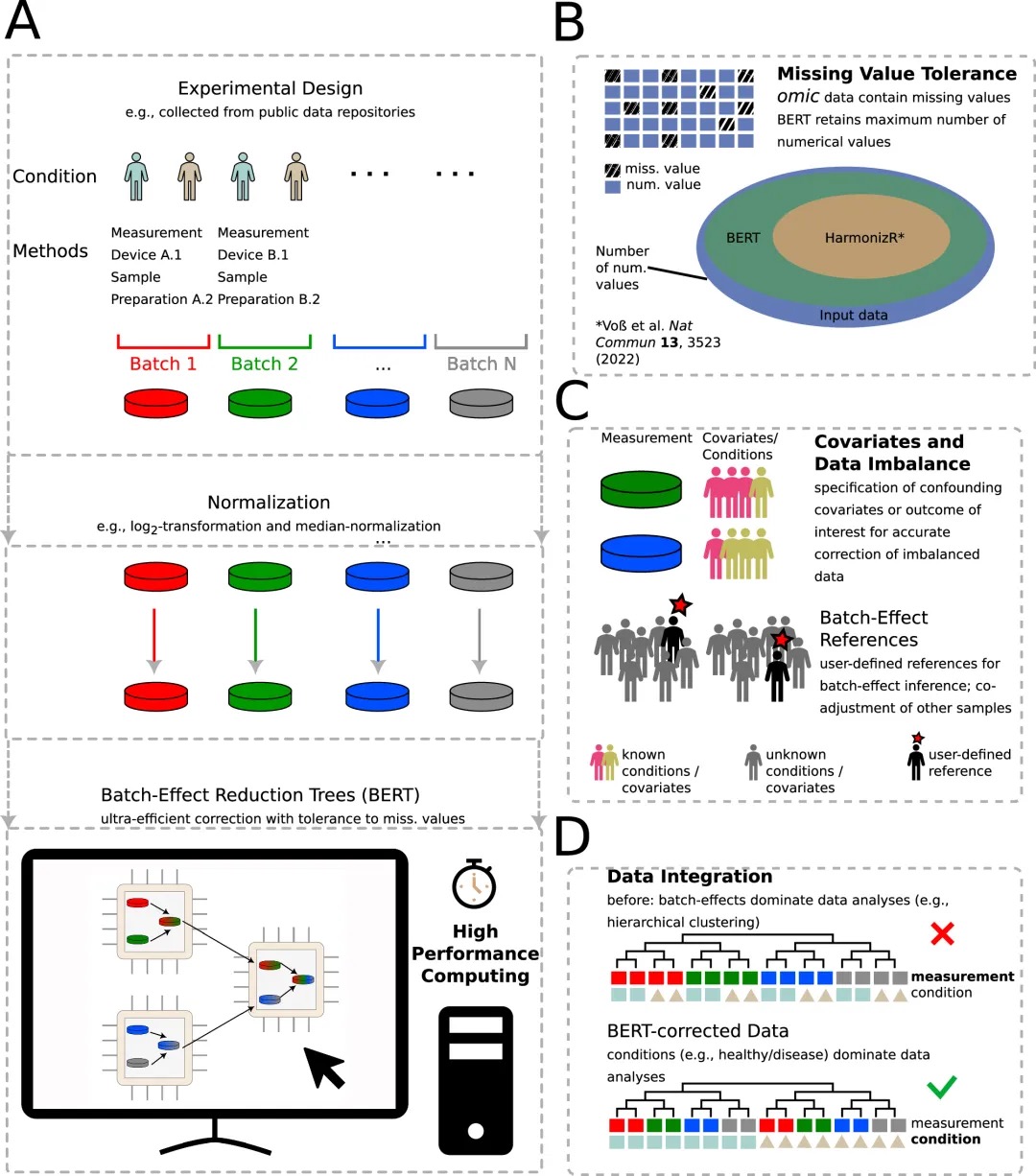
5.(Nat Commun,IF:14.7)使用批处理效应减少树(BERT)进行大规模不完整组学数据整合的高性能方法

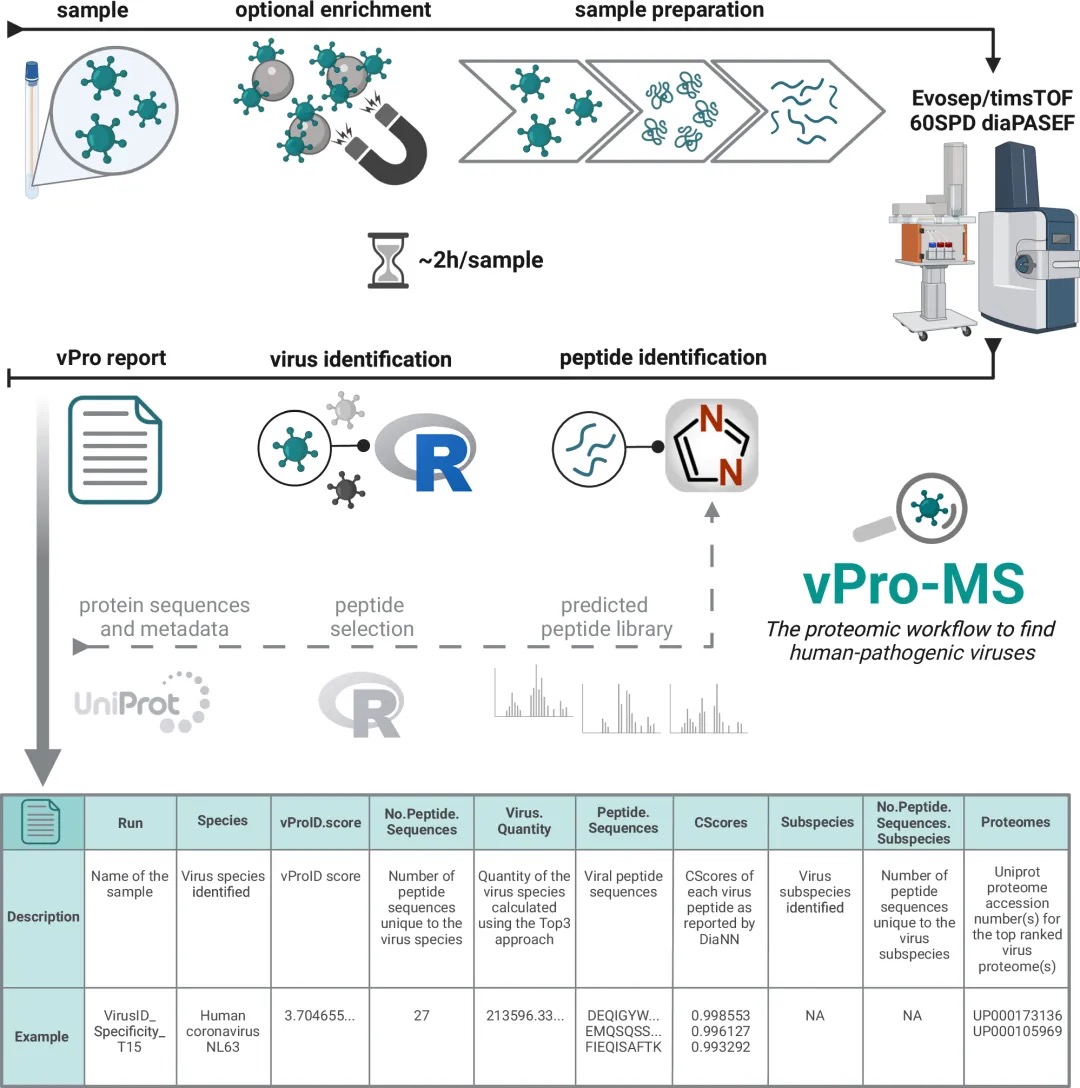
6.(Nat Commun,IF:14.7)vPro-MS 通过非靶向蛋白质组学从患者样本中鉴定人类致病病毒

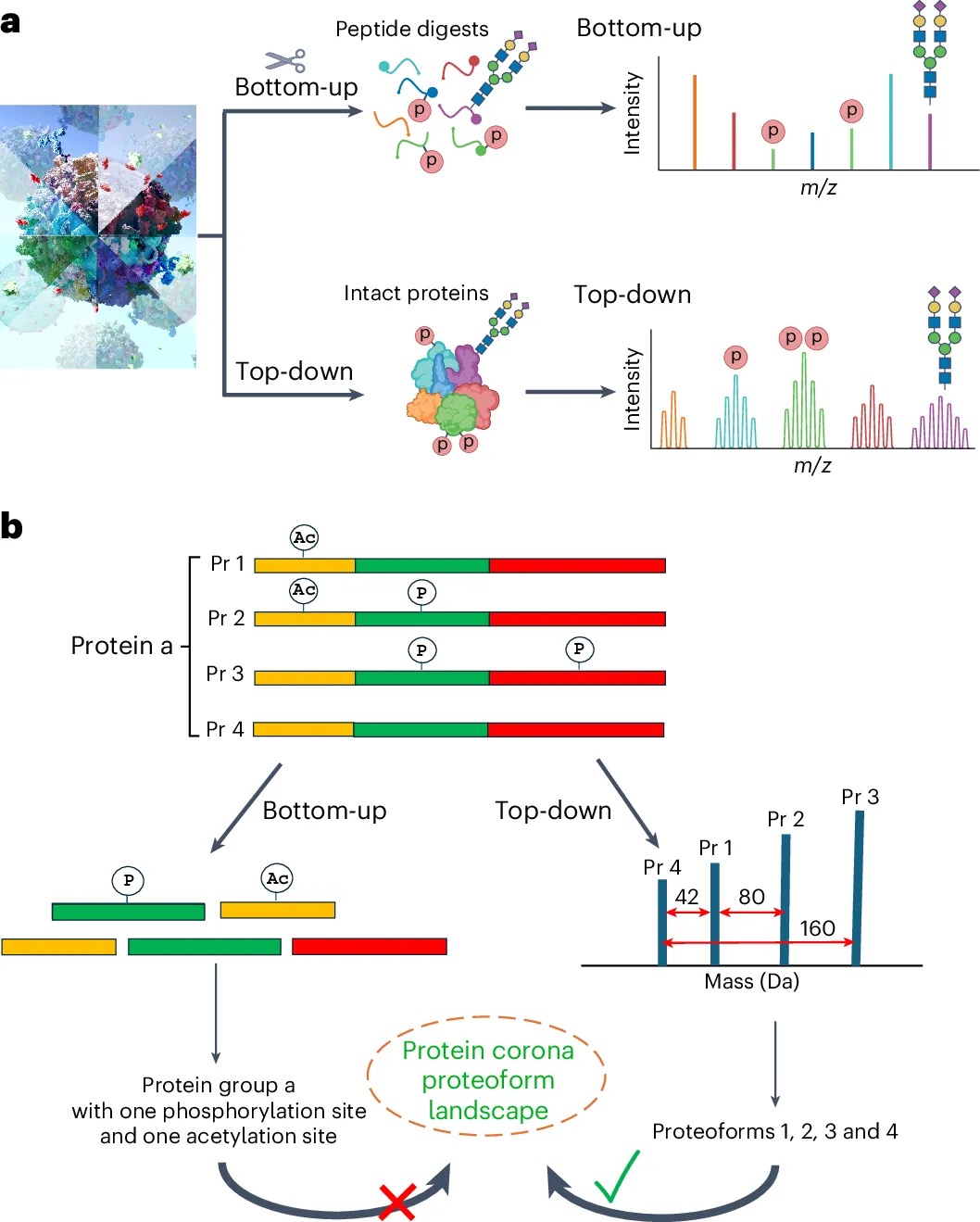
7.(Nat Protoc,IF:13.1)基于毛细管区带电泳质谱的自上而下蛋白质组学用于蛋白冠的蛋白形式分析

8.(Alzheimers Dement,IF:13.0)阿尔茨海默病中淀粉样蛋白、tau蛋白与炎症病理生理学关系的综合视图

1 (Cancer Cell) 肺腺癌在不同种族和暴露下的综合分析
2 (Circulation) 单细胞多组学鉴定急性心肌炎中具有细胞毒性和迁移性的CD8(+)效应T细胞亚群
3 (Gut) 空间单细胞组学:肝脏疾病的新见解
4 (J Extracell Vesicles) 自发性高血压大鼠的外膜成纤维细胞通过转移骨桥蛋白促进血管重塑
5 (Nat Commun)使用批处理效应减少树(BERT)进行大规模不完整组学数据整合的高性能方法
6 (Nat Commun) vPro-MS 通过非靶向蛋白质组学从患者样本中鉴定人类致病病毒
7 (Nat Protoc) 基于毛细管区带电泳质谱的自上而下蛋白质组学用于蛋白冠的蛋白形式分析
8 (Alzheimers Dement) 阿尔茨海默病中淀粉样蛋白、tau蛋白与炎症病理生理学关系的综合视图


2. (Circulation,IF:35.5)单细胞多组学鉴定急性心肌炎中具有细胞毒性和迁移性的CD8(+)效应T细胞亚群


3.(Gut,IF:23.0)空间单细胞组学:肝脏疾病的新见解


4.(J Extracell Vesicles,IF:15.5)自发性高血压大鼠的外膜成纤维细胞通过转移骨桥蛋白促进血管重塑


5.(Nat Commun,IF:14.7)使用批处理效应减少树(BERT)进行大规模不完整组学数据整合的高性能方法


6.(Nat Commun,IF:14.7)vPro-MS 通过非靶向蛋白质组学从患者样本中鉴定人类致病病毒


7.(Nat Protoc,IF:13.1)基于毛细管区带电泳质谱的自上而下蛋白质组学用于蛋白冠的蛋白形式分析


8.(Alzheimers Dement,IF:13.0)阿尔茨海默病中淀粉样蛋白、tau蛋白与炎症病理生理学关系的综合视图