1 (NAT BIOMED ENG) 多器官成像遗传学和蛋白质组学揭示脑-心-眼轴
2 (CIRC RES) GP130拮抗作用增强猪RV功能
3 (ACS NANO) 用于肝脏和结肠肿瘤免疫治疗的自佐剂凝胶对肿瘤和淋巴结的分层递送
4 (SCI TRANSL MED) S-亚硝基谷胱甘肽还原酶作为糖尿病血管并发症的治疗靶点在啮齿动物模型中的研究
5 (NAT COMMUN) 在高动态范围基准集上评估人类血浆无标记定量的多中心研究
6 (NAT COMMUN) 左手DNA实现单蛋白分辨率的高效多重成像
7 (NAT COMMUN) 以组蛋白为中心的多组学研究表明,H3K4甲基化增加维持了三阴性乳腺癌表型
8 (NAT COMMUN) 人类唐氏综合症和三体小鼠大脑的分子图谱
9 (J AM CHEM SOC) 同位素信号增强质谱法实现RNA结合蛋白的位点特异性分析
一起来看看本期的蛋白质组学精选优质文献吧!

1. (Nature Biomedical Engineering,IF:26.8) 多器官成像遗传学和蛋白质组学揭示脑-心-眼轴
原文链接: https://pubmed.ncbi.nlm.nih.gov/40935702/

2. (Circulation Research,IF:16.5)GP130拮抗作用增强猪RV功能
3. (ACS Nano,IF:15.8)用于肝脏和结肠肿瘤免疫治疗的自佐剂凝胶对肿瘤和淋巴结的分层递送
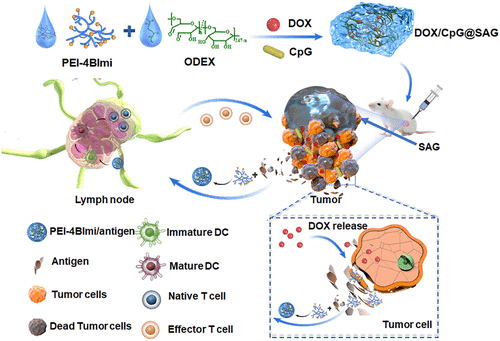
DOX/CpG@SAG用于肿瘤治疗的制备与机制示意图

4. (Science Translational Medicine,IF:15.8)S-亚硝基谷胱甘肽还原酶作为糖尿病血管并发症的治疗靶点在啮齿动物模型中的研究
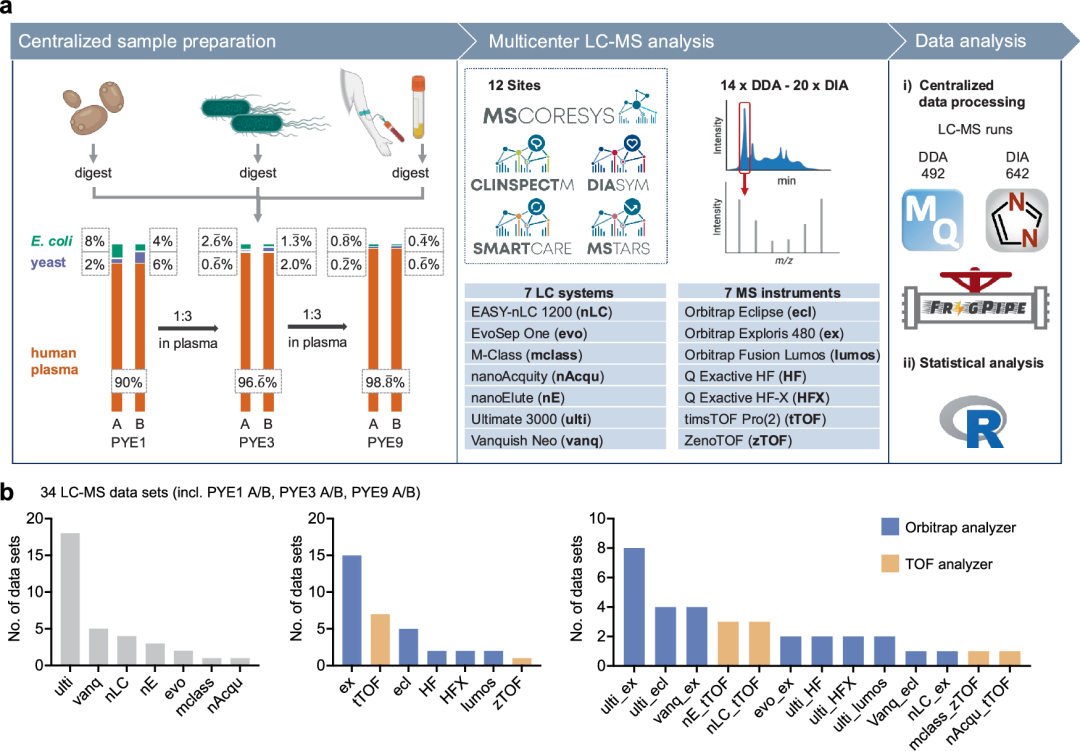
PYE样本集及研究设计概览
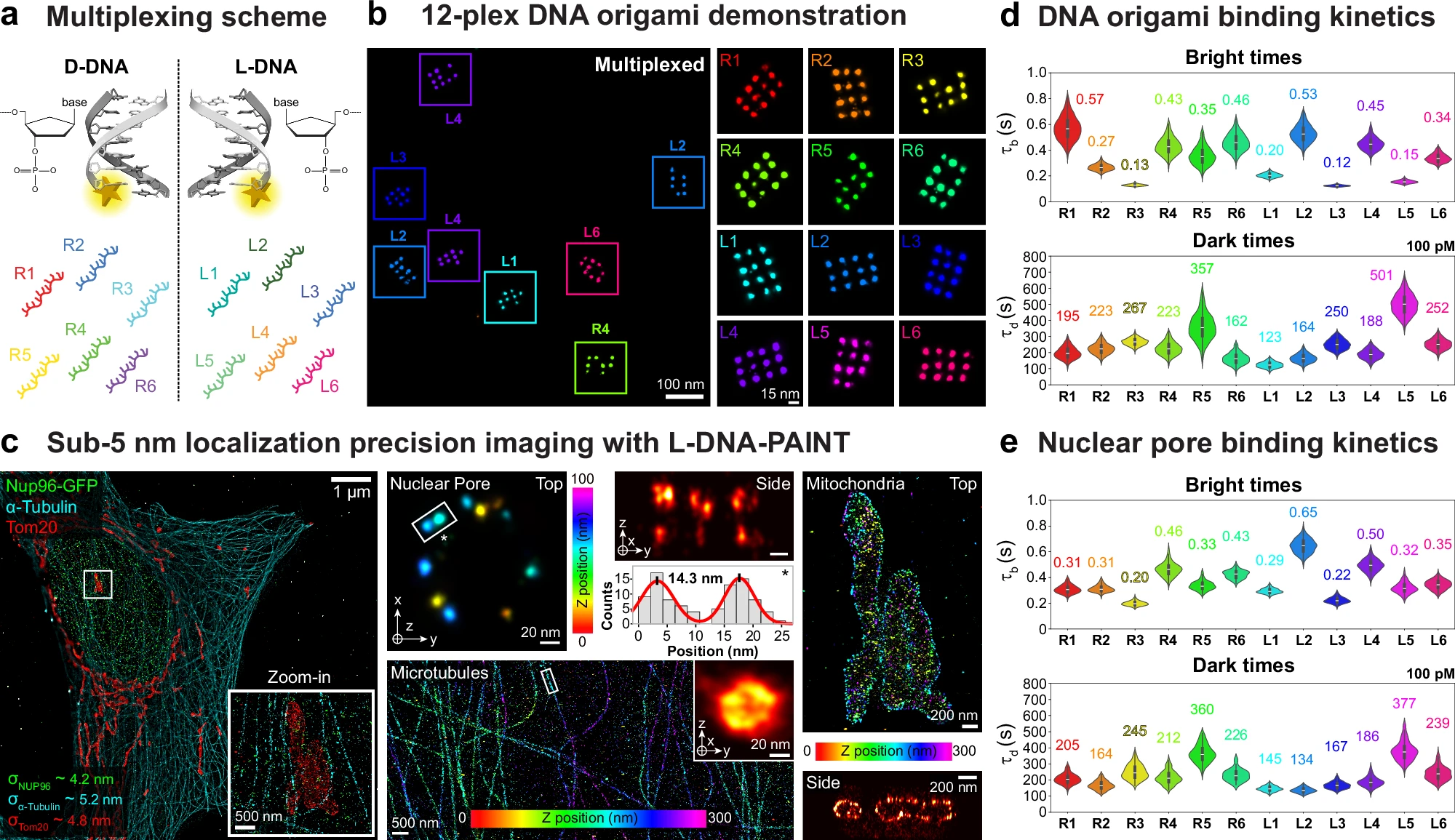
利用左手性(镜像)DNA对速度进行优化的DNA-PAINT技术改进。
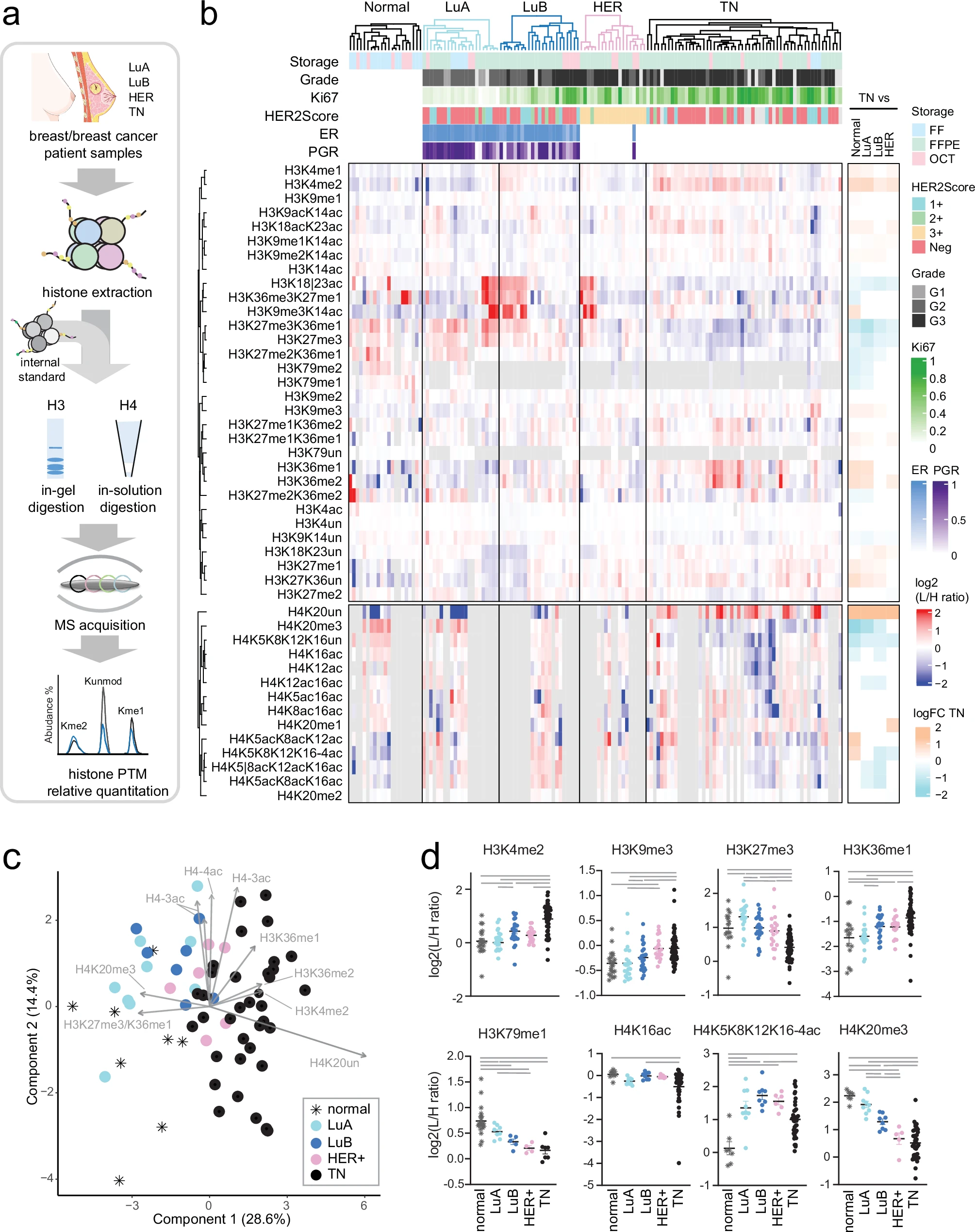
基于质谱法的乳腺癌分子亚型组蛋白翻译后修饰(PTM)图谱分析
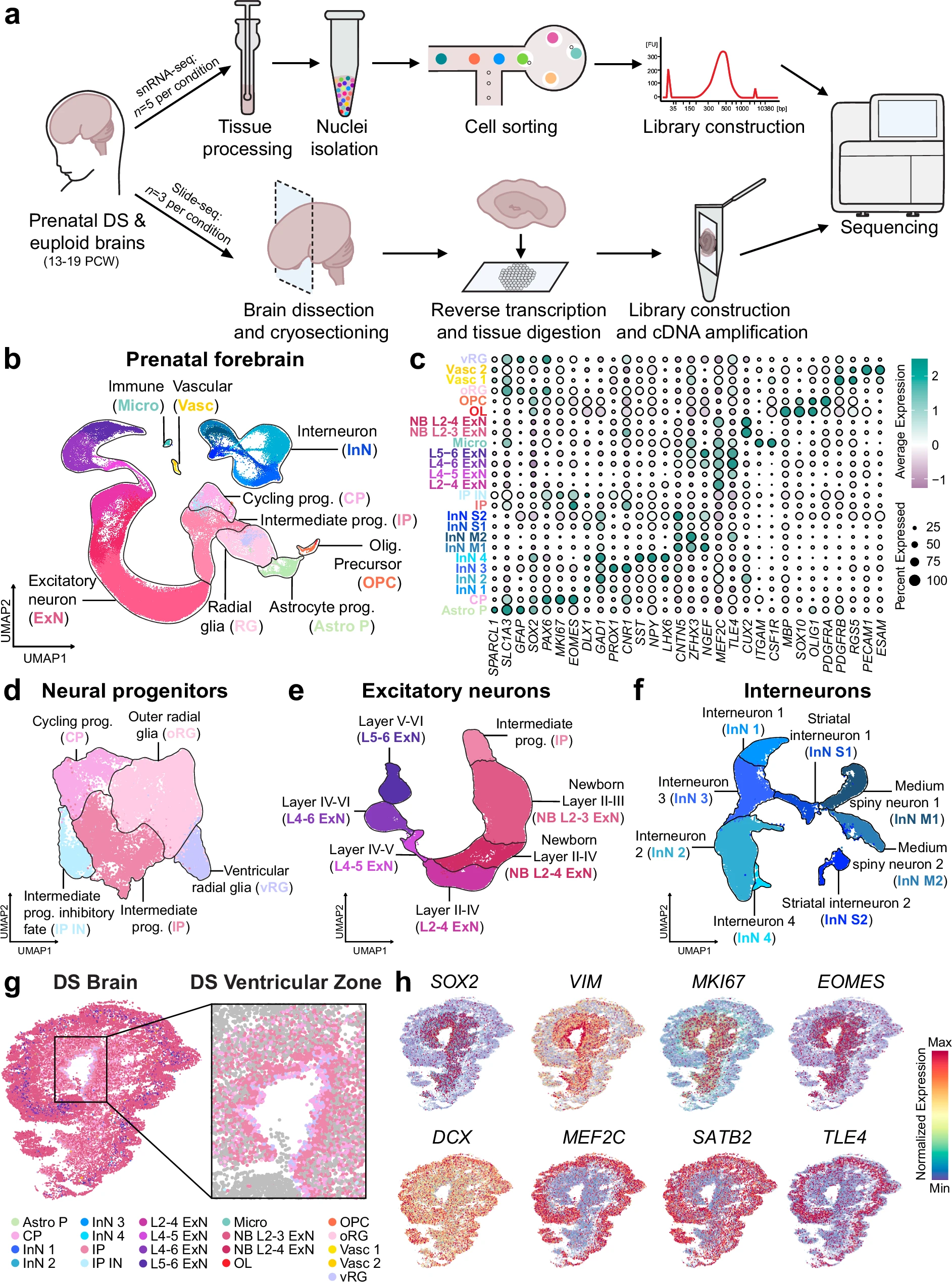
产前唐氏综合征和正常二倍体大脑的细胞特征分析。
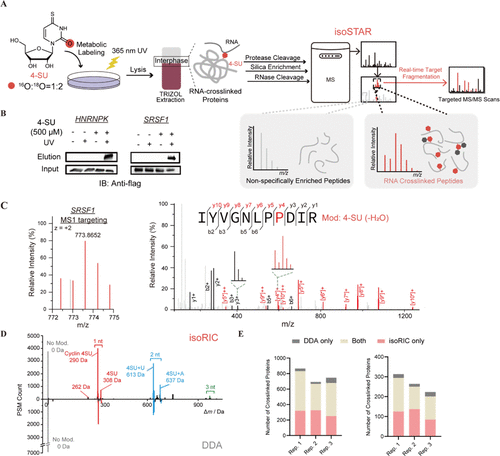
通过 isoRIC 实现 RNA 结合蛋白的位点特异性分析
1 (NAT BIOMED ENG) 多器官成像遗传学和蛋白质组学揭示脑-心-眼轴
2 (CIRC RES) GP130拮抗作用增强猪RV功能
3 (ACS NANO) 用于肝脏和结肠肿瘤免疫治疗的自佐剂凝胶对肿瘤和淋巴结的分层递送
4 (SCI TRANSL MED) S-亚硝基谷胱甘肽还原酶作为糖尿病血管并发症的治疗靶点在啮齿动物模型中的研究
5 (NAT COMMUN) 在高动态范围基准集上评估人类血浆无标记定量的多中心研究
6 (NAT COMMUN) 左手DNA实现单蛋白分辨率的高效多重成像
7 (NAT COMMUN) 以组蛋白为中心的多组学研究表明,H3K4甲基化增加维持了三阴性乳腺癌表型
8 (NAT COMMUN) 人类唐氏综合症和三体小鼠大脑的分子图谱
9 (J AM CHEM SOC) 同位素信号增强质谱法实现RNA结合蛋白的位点特异性分析
一起来看看本期的蛋白质组学精选优质文献吧!

1. (Nature Biomedical Engineering,IF:26.8) 多器官成像遗传学和蛋白质组学揭示脑-心-眼轴
原文链接: https://pubmed.ncbi.nlm.nih.gov/40935702/

2. (Circulation Research,IF:16.5)GP130拮抗作用增强猪RV功能
3. (ACS Nano,IF:15.8)用于肝脏和结肠肿瘤免疫治疗的自佐剂凝胶对肿瘤和淋巴结的分层递送

DOX/CpG@SAG用于肿瘤治疗的制备与机制示意图

4. (Science Translational Medicine,IF:15.8)S-亚硝基谷胱甘肽还原酶作为糖尿病血管并发症的治疗靶点在啮齿动物模型中的研究

PYE样本集及研究设计概览

利用左手性(镜像)DNA对速度进行优化的DNA-PAINT技术改进。

基于质谱法的乳腺癌分子亚型组蛋白翻译后修饰(PTM)图谱分析

产前唐氏综合征和正常二倍体大脑的细胞特征分析。

通过 isoRIC 实现 RNA 结合蛋白的位点特异性分析








