
文章标题
本研究通过构建一个包含13种人体组织、覆盖50年生命周期的跨学科蛋白质组图谱,为理解衰老的多层次机制提供了新的视角。通过对这些组织的系统性分析,研究不仅揭示了衰老过程中的蛋白质稳态失衡,还阐明了不同器官在衰老过程中的特异性变化,并揭示了衰老过程中器官间复杂的通讯机制。
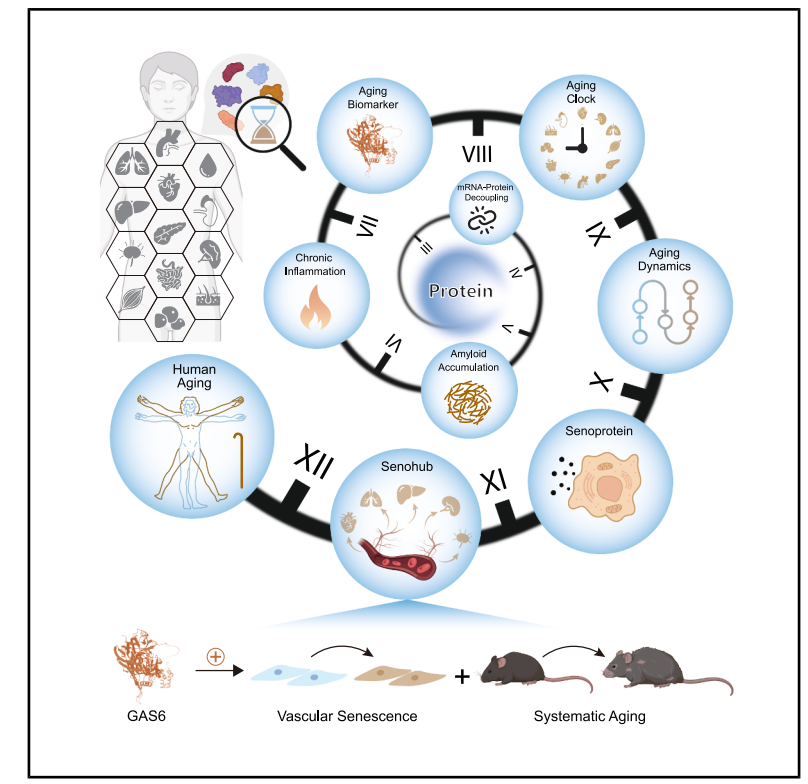
图形摘要
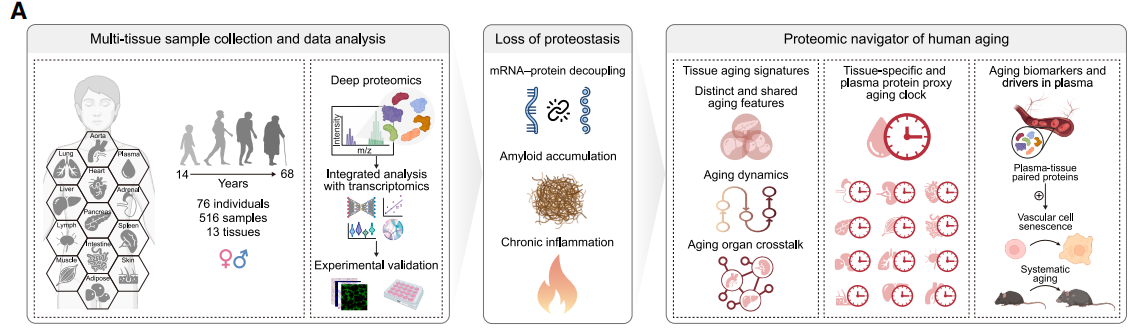
图1. 多组织蛋白质组图谱勾勒出与年龄和组织相关的蛋白质特征
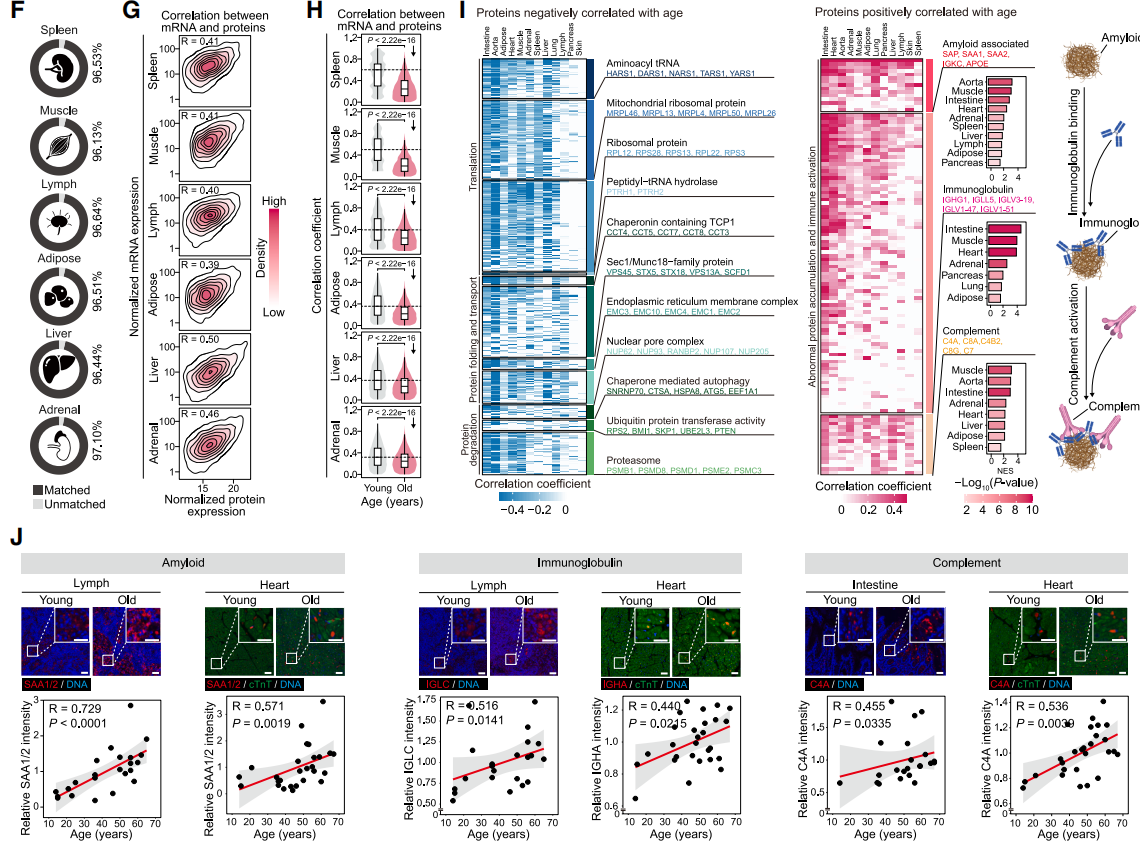
图2. 衰老扰乱多组织mRNA-蛋白质耦联与蛋白质组稳态
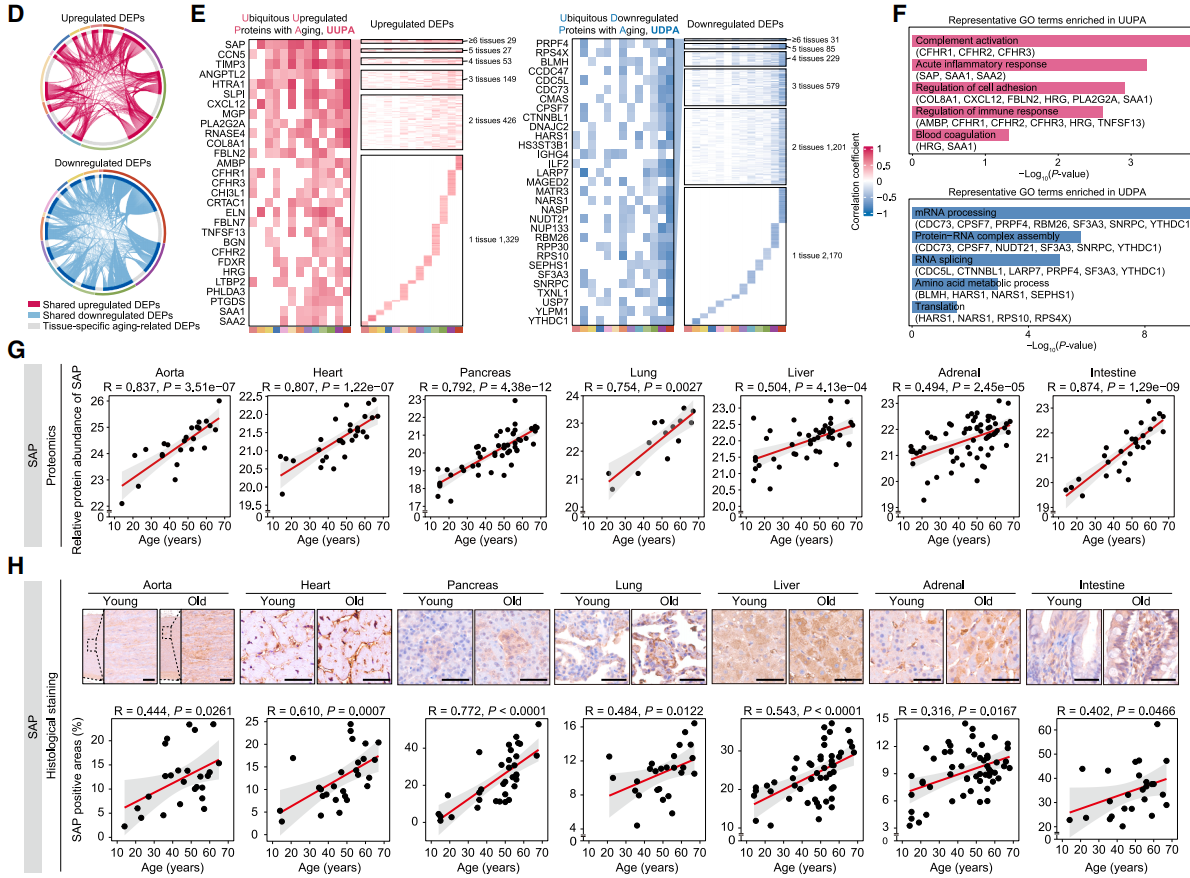
图3. 年龄依赖性差异表达蛋白的分子特征分析
♦ 构建蛋白质衰老时钟并发现衰老拐点
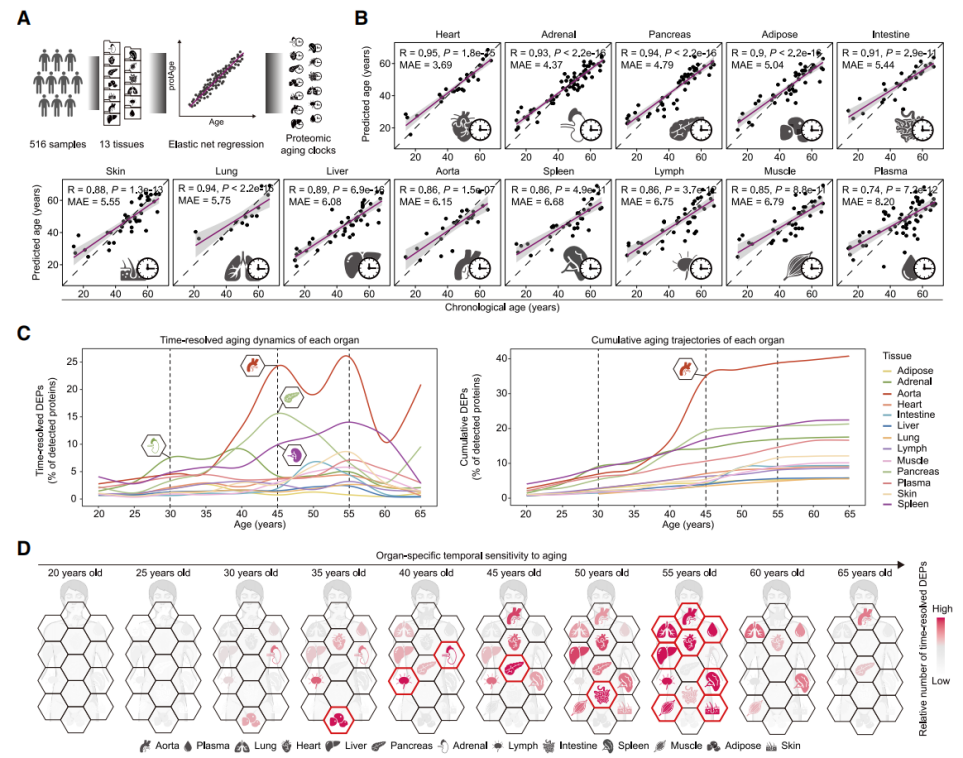
图4. 衰老相关蛋白及分泌因子的动态谱学分析
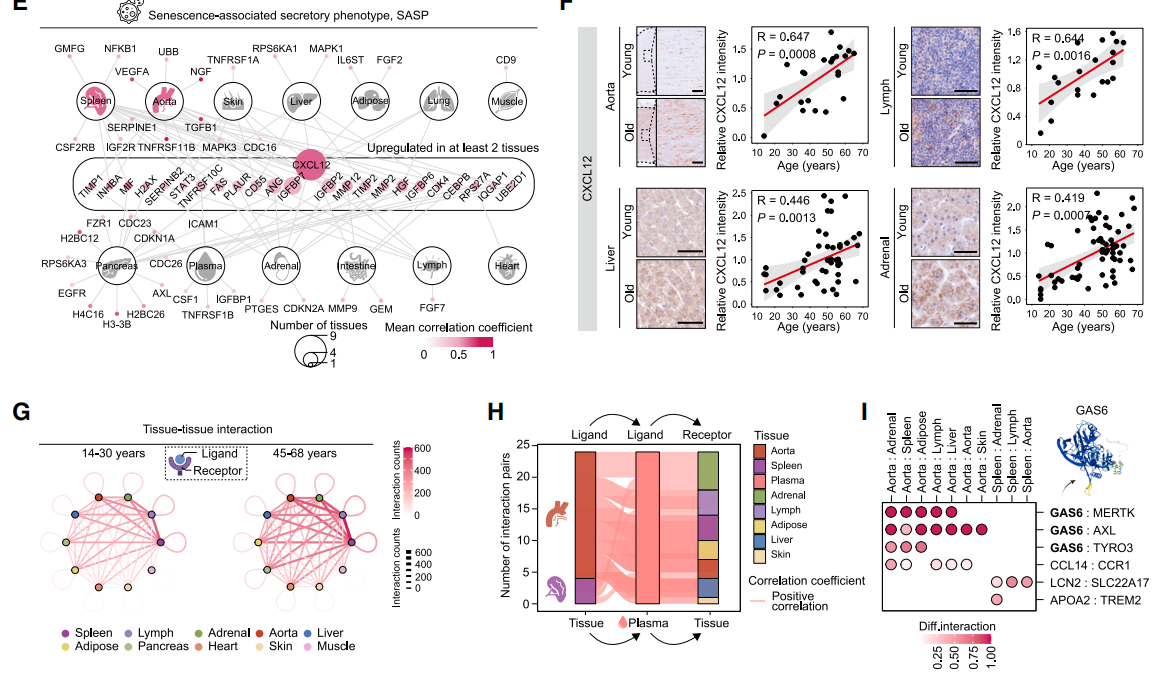
图5. GAS6蛋白促进人类内皮细胞衰老及小鼠多器官老化
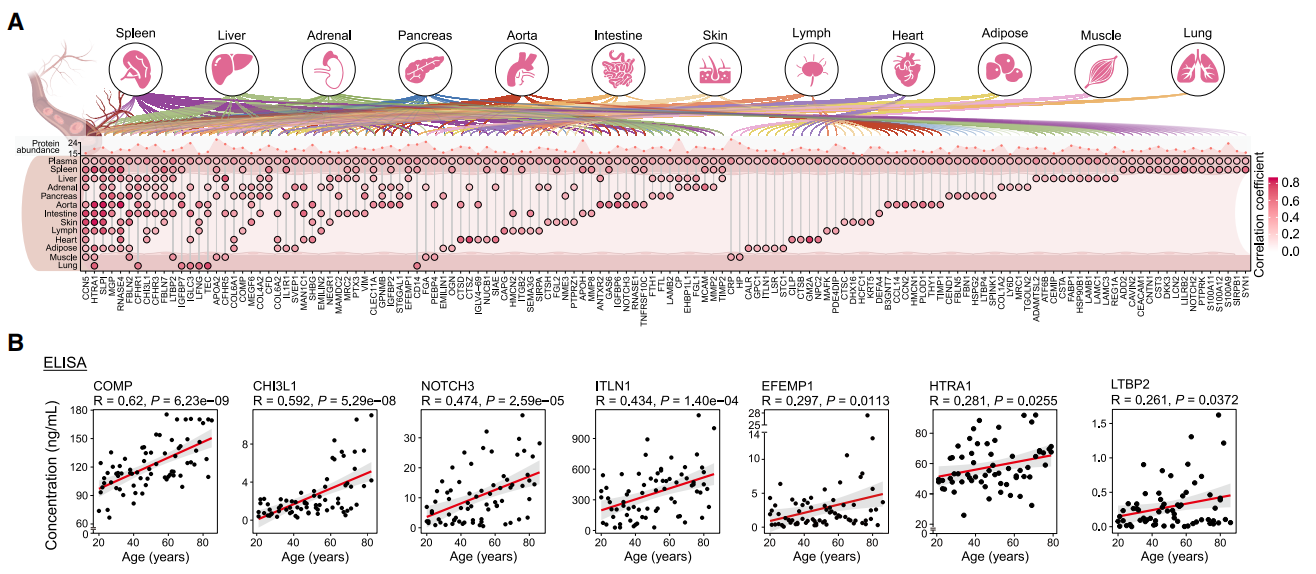
图6. 在人血浆与组织中协同上调的蛋白质
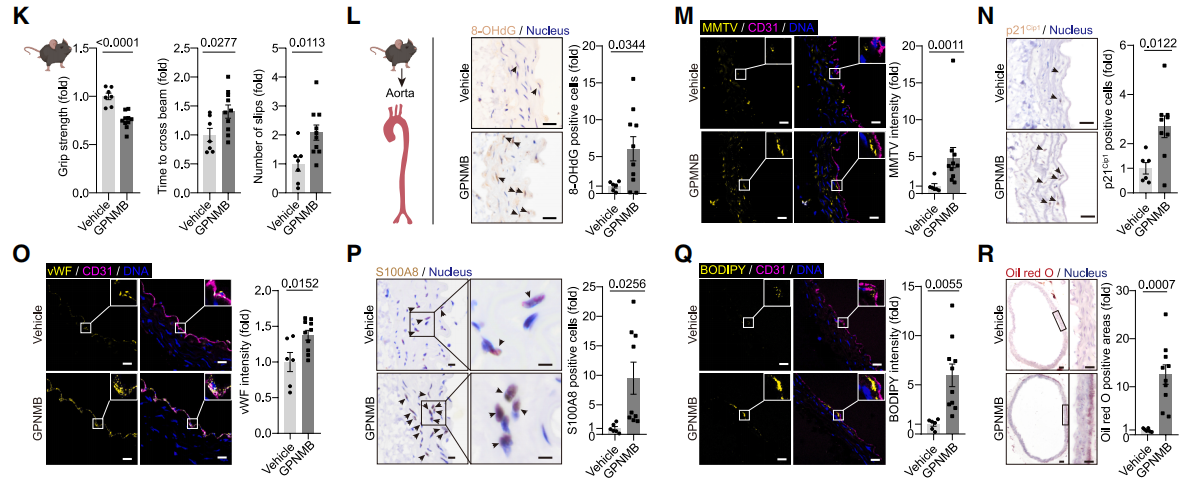
图7. 血浆衰老蛋白驱动血管与全身衰老

文章标题
本研究通过构建一个包含13种人体组织、覆盖50年生命周期的跨学科蛋白质组图谱,为理解衰老的多层次机制提供了新的视角。通过对这些组织的系统性分析,研究不仅揭示了衰老过程中的蛋白质稳态失衡,还阐明了不同器官在衰老过程中的特异性变化,并揭示了衰老过程中器官间复杂的通讯机制。

图形摘要

图1. 多组织蛋白质组图谱勾勒出与年龄和组织相关的蛋白质特征

图2. 衰老扰乱多组织mRNA-蛋白质耦联与蛋白质组稳态

图3. 年龄依赖性差异表达蛋白的分子特征分析
♦ 构建蛋白质衰老时钟并发现衰老拐点

图4. 衰老相关蛋白及分泌因子的动态谱学分析

图5. GAS6蛋白促进人类内皮细胞衰老及小鼠多器官老化

图6. 在人血浆与组织中协同上调的蛋白质

图7. 血浆衰老蛋白驱动血管与全身衰老








