本研究利用短寿命鳉鱼模型,通过整合RNA测序、蛋白质组学、翻译组学等多组学技术,深入探究了大脑衰老进程。研究发现,衰老大脑中蛋白质丰度与RNA水平的关联减弱,其核心原因并非蛋白质稳定性下降,而是翻译效率降低,特别是翻译延伸过程受阻(核糖体停滞)。这导致富含精氨酸等碱性氨基酸的关键蛋白质(如核酸结合蛋白)合成减少和功能下降。同时,线粒体组成变化也加速了衰老相关的功能衰退。该工作将翻译障碍和蛋白质稳态失衡确立为大脑衰老的关键标志,并揭示了其通过影响基因组稳定性、RNA加工、蛋白质合成及线粒体功能,串联起其他衰老特征,也为理解神经退行性疾病提供了新视角。
01
从基因到蛋白:哪里出了问题?
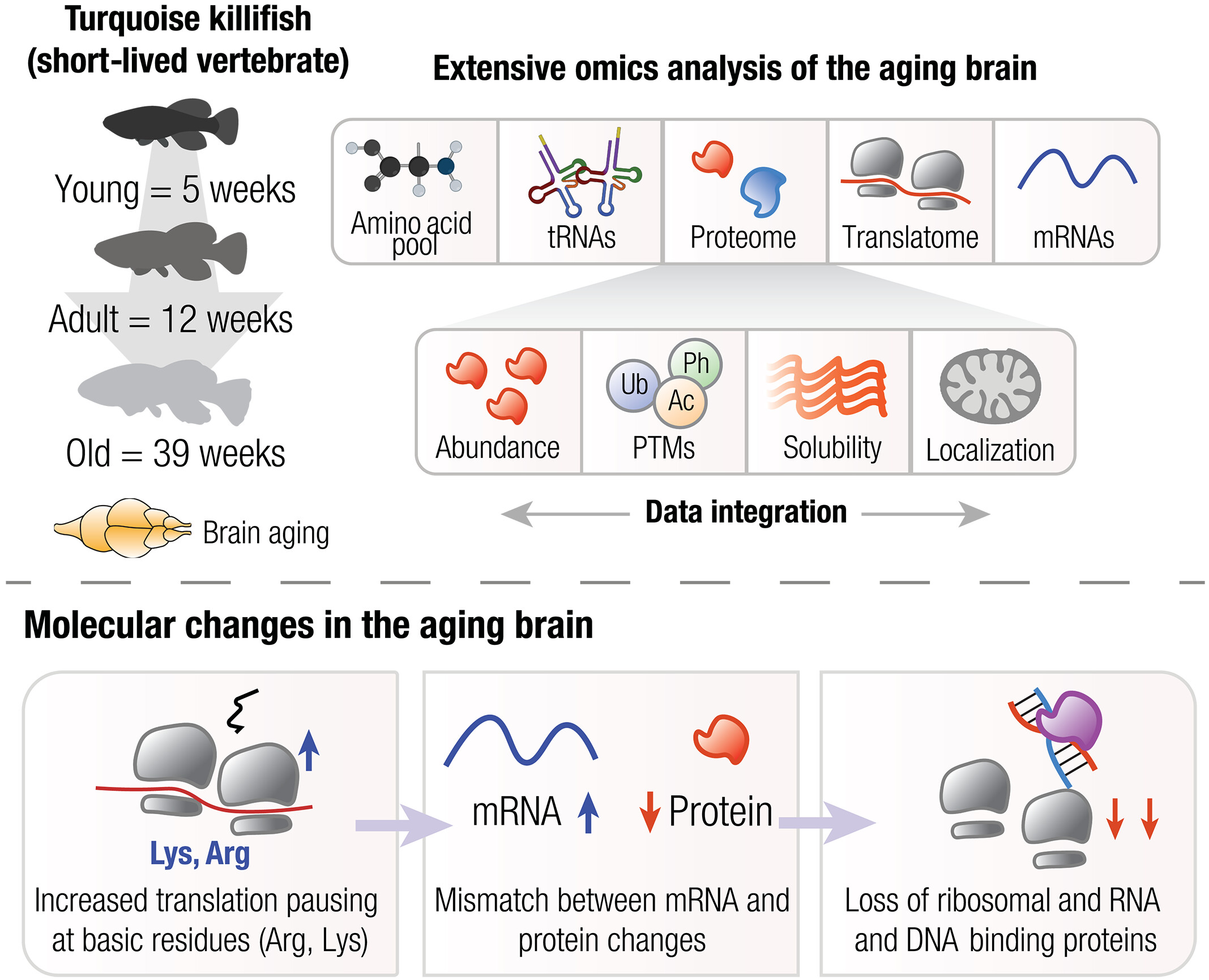
氨基酸浓度 tRNA、mRNA、正在被翻译的mRNA(转录组+翻译组) 蛋白质组、翻译后修饰(磷酸化、泛素化、乙酰化) 蛋白溶解度、细胞器组成
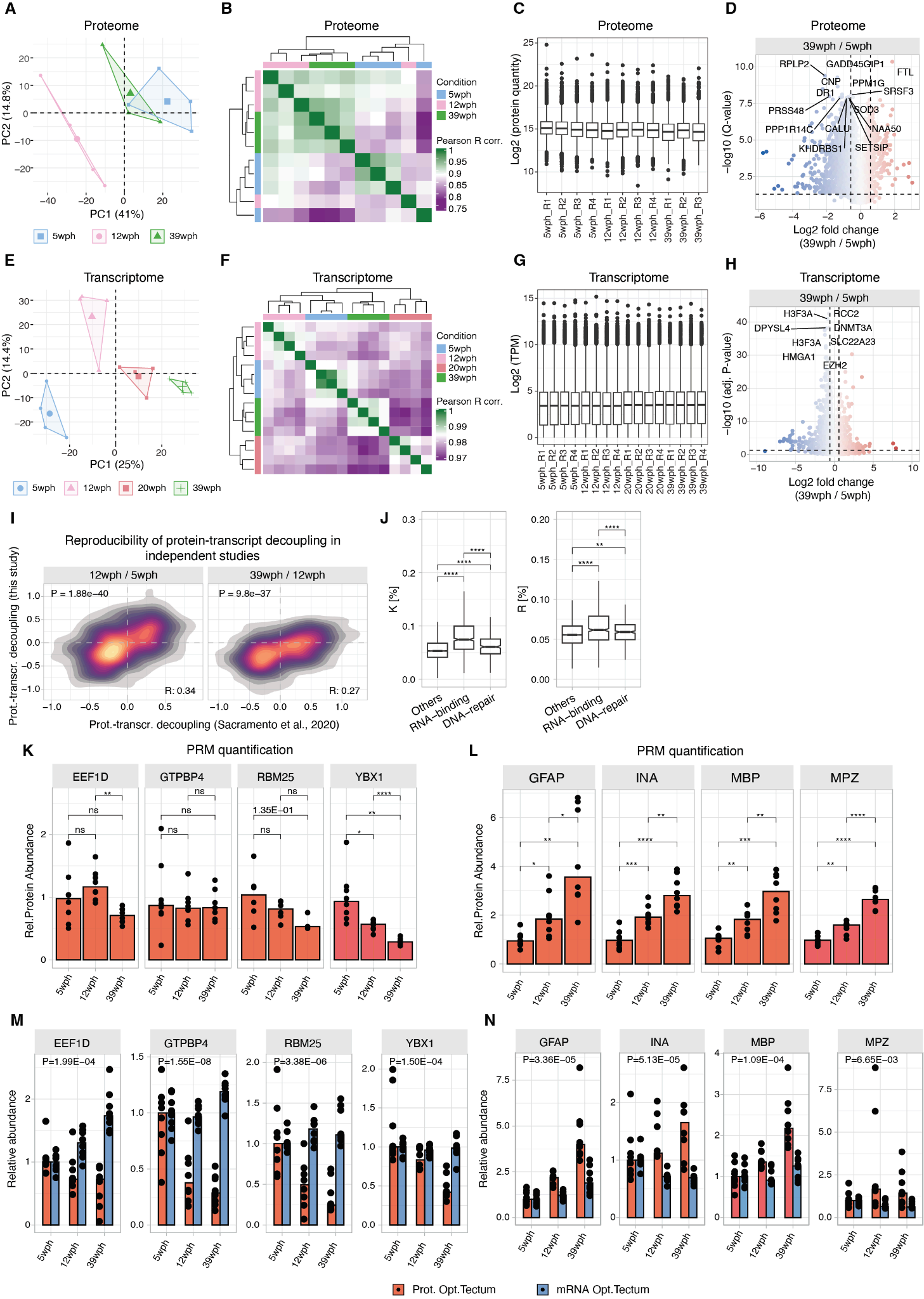
Proteome and transcriptome characterization of the killifish aging brain.
02
核心发现:翻译卡壳,卡在“碱性密码子”
老年大脑核糖体更容易“卡住”(翻译停顿) 停顿位置集中在编码赖氨酸(Lys)和精氨酸(Arg)的密码子段 这些氨基酸在DNA/RNA结合蛋白中比例极高
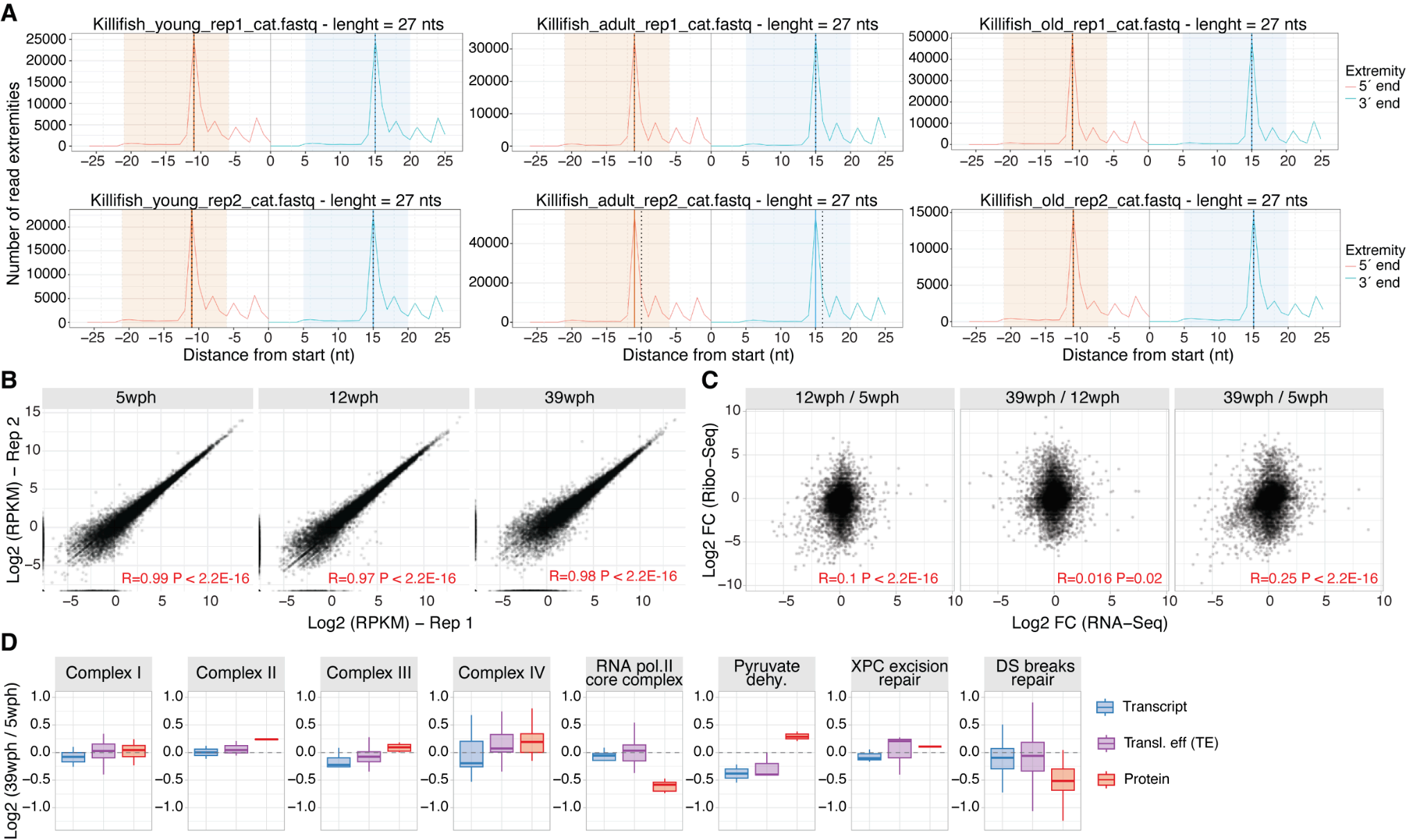
Ribosome profiling in the killifish aging brain.
03
影响深远:从基因维护到线粒体功能
衰老影响了线粒体组成,可能加剧能量代谢障碍 部分蛋白降解途径(如蛋白酶体)受损,但与翻译缺陷的影响机制不同
这些变化之间存在交织与放大效应,构成了衰老的多重“分子漩涡”
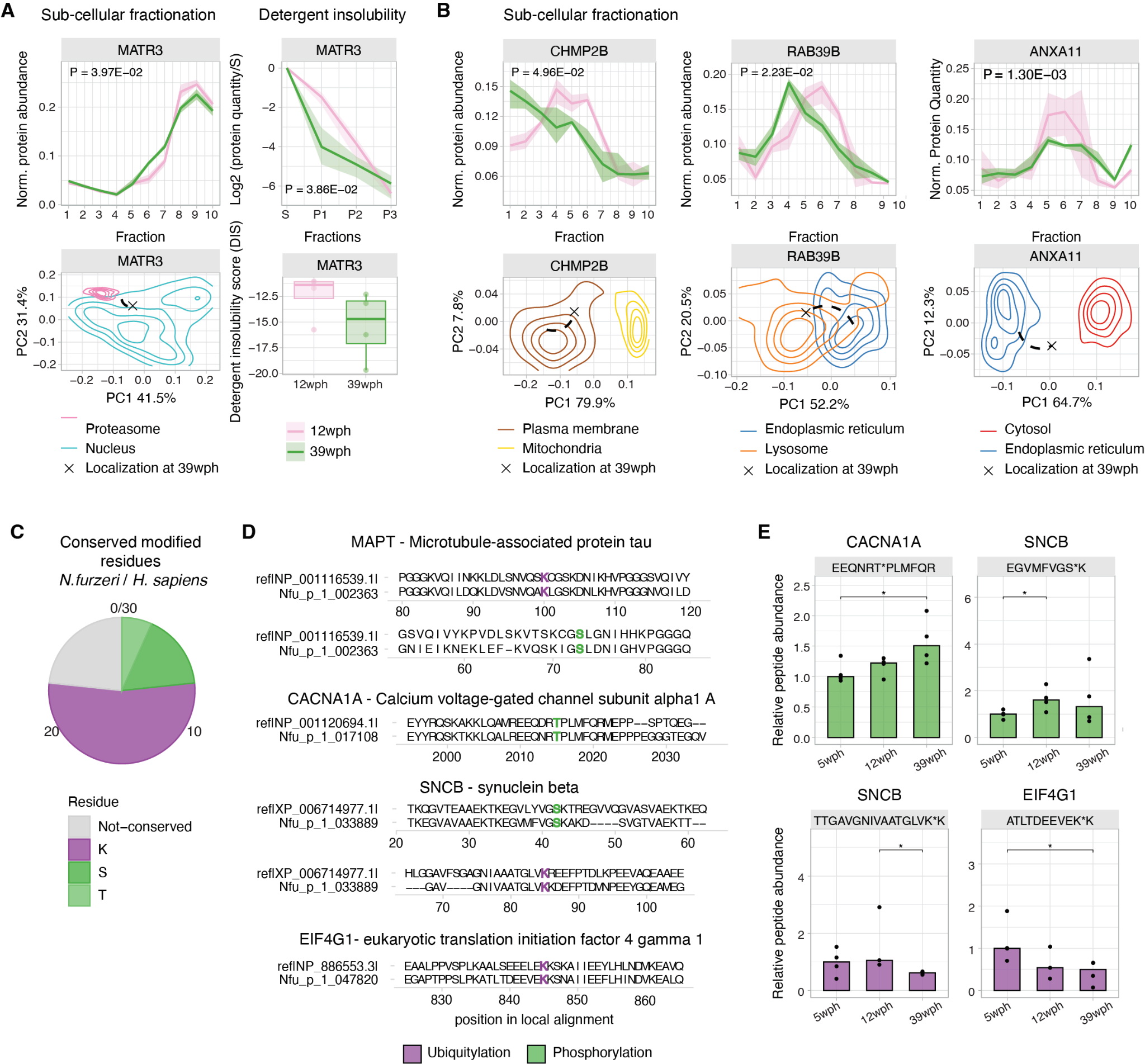
Age-associated alterations of proteins linked to human neurodegenerative disorders.
04
科学与应用的启示
新靶点探索: 针对翻译延伸过程和核糖体卡顿的干预,可能延缓蛋白质组的衰老。
保护DNA/RNA结合蛋白的合成,有望改善基因组维护和转录调控。
疾病关联:与神经退行性疾病的病理机制高度契合,为药物研发提供了新思路。 模型价值:短寿命杀鱼模型可加速衰老研究周期,助力新型抗衰策略的验证。
05
小结

本研究利用短寿命鳉鱼模型,通过整合RNA测序、蛋白质组学、翻译组学等多组学技术,深入探究了大脑衰老进程。研究发现,衰老大脑中蛋白质丰度与RNA水平的关联减弱,其核心原因并非蛋白质稳定性下降,而是翻译效率降低,特别是翻译延伸过程受阻(核糖体停滞)。这导致富含精氨酸等碱性氨基酸的关键蛋白质(如核酸结合蛋白)合成减少和功能下降。同时,线粒体组成变化也加速了衰老相关的功能衰退。该工作将翻译障碍和蛋白质稳态失衡确立为大脑衰老的关键标志,并揭示了其通过影响基因组稳定性、RNA加工、蛋白质合成及线粒体功能,串联起其他衰老特征,也为理解神经退行性疾病提供了新视角。

01
从基因到蛋白:哪里出了问题?
氨基酸浓度 tRNA、mRNA、正在被翻译的mRNA(转录组+翻译组) 蛋白质组、翻译后修饰(磷酸化、泛素化、乙酰化) 蛋白溶解度、细胞器组成

Proteome and transcriptome characterization of the killifish aging brain.
02
核心发现:翻译卡壳,卡在“碱性密码子”
老年大脑核糖体更容易“卡住”(翻译停顿) 停顿位置集中在编码赖氨酸(Lys)和精氨酸(Arg)的密码子段 这些氨基酸在DNA/RNA结合蛋白中比例极高

Ribosome profiling in the killifish aging brain.
03
影响深远:从基因维护到线粒体功能
衰老影响了线粒体组成,可能加剧能量代谢障碍 部分蛋白降解途径(如蛋白酶体)受损,但与翻译缺陷的影响机制不同
这些变化之间存在交织与放大效应,构成了衰老的多重“分子漩涡”

Age-associated alterations of proteins linked to human neurodegenerative disorders.
04
科学与应用的启示
新靶点探索: 针对翻译延伸过程和核糖体卡顿的干预,可能延缓蛋白质组的衰老。
保护DNA/RNA结合蛋白的合成,有望改善基因组维护和转录调控。
疾病关联:与神经退行性疾病的病理机制高度契合,为药物研发提供了新思路。 模型价值:短寿命杀鱼模型可加速衰老研究周期,助力新型抗衰策略的验证。
05
小结