研究背景
小细胞肺癌(SCLC)约占肺癌的15%,具有侵袭性强、转移率高的特点,多数患者确诊时已处晚期。尽管采用标准化疗联合免疫治疗,其3年生存率仍不足20%。核心问题是抗原呈递机制受抑、免疫细胞浸润少,导致免疫检查点抑制剂(ICB)响应有限。SCLC基因层面相对同质,缺乏经典可成药驱动基因,且肿瘤标本获取困难,限制了靶向治疗和生物标志物开发。虽已基于转录因子划分为A、N、P、I等亚型,但仍需更可靠的免疫治疗应答预测标志物。
2025年12月2日,阿斯利康全球多部门与德克萨斯大学MD安德森癌症中心的团队在Molecular Cancer上联合发表了题为“Multi-omic profiling provides insights into the heterogeneity, microenvironmental features, and biomarker landscape of small-cell lung cancer”的研究。该研究对159例未经系统治疗的SCLC切除组织,通过多组学整合分析,系统解析了SCLC的分子异质性、免疫微环境特征及潜在生物标志物,尤其聚焦于MHC-I表达与免疫细胞空间分布的关系,为理解SCLC生物学复杂性及指导免疫治疗提供了新的见解。

文章标题
实验设计
样本队列:159例未经系统治疗的SCLC患者的福尔马林固定石蜡包埋(FFPE)肿瘤手术切除样本。
关键特征:疾病分期涵盖I–IV期,所有样本采集于免疫治疗前(2001-2018年),避免了治疗对分子特征的干扰。
技术方法:利用多组学(基因、表观、转录、蛋白组)发现规律,利用免疫组织化学(IHC)和多重免疫荧光(mIF)进行验证和空间定位。
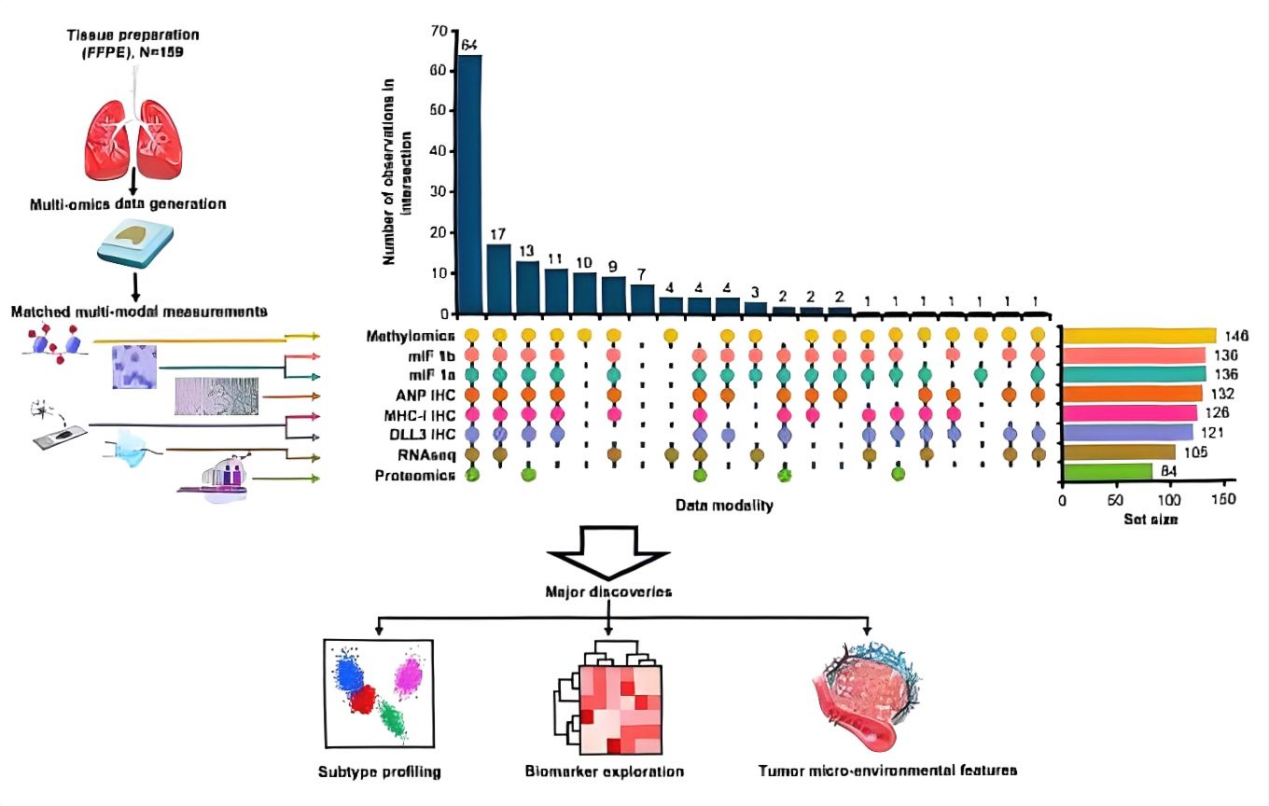
Fig.1 整体实验设计流程
研究结果
1. 多组学分析揭示SCLC分子亚型高度异质
研究首先通过对159例SCLC患者的多组学数据整合分析,确立了SCLC的分子亚型分类框架(Fig.2A)。神经内分泌亚型(SCLC-A/N)以ASCL1和NEUROD1高表达为特征,而非神经内分泌亚型(SCLC-P/ANP-negative)高表达POU2F3(Fig.2B-C)。值得注意的是,IHC与RNA-seq亚型分类在约15%的样本中存在不一致性,且免疫相关基因在非神经内分泌亚型中特异性富集(Fig.2D-E),提示亚型特异性通路激活是SCLC异质性的核心特征。

Fig.2 多组学分析揭示SCLC分子亚型高度异质
2. MHC-I高表达关联非神经内分泌亚型与免疫浸润
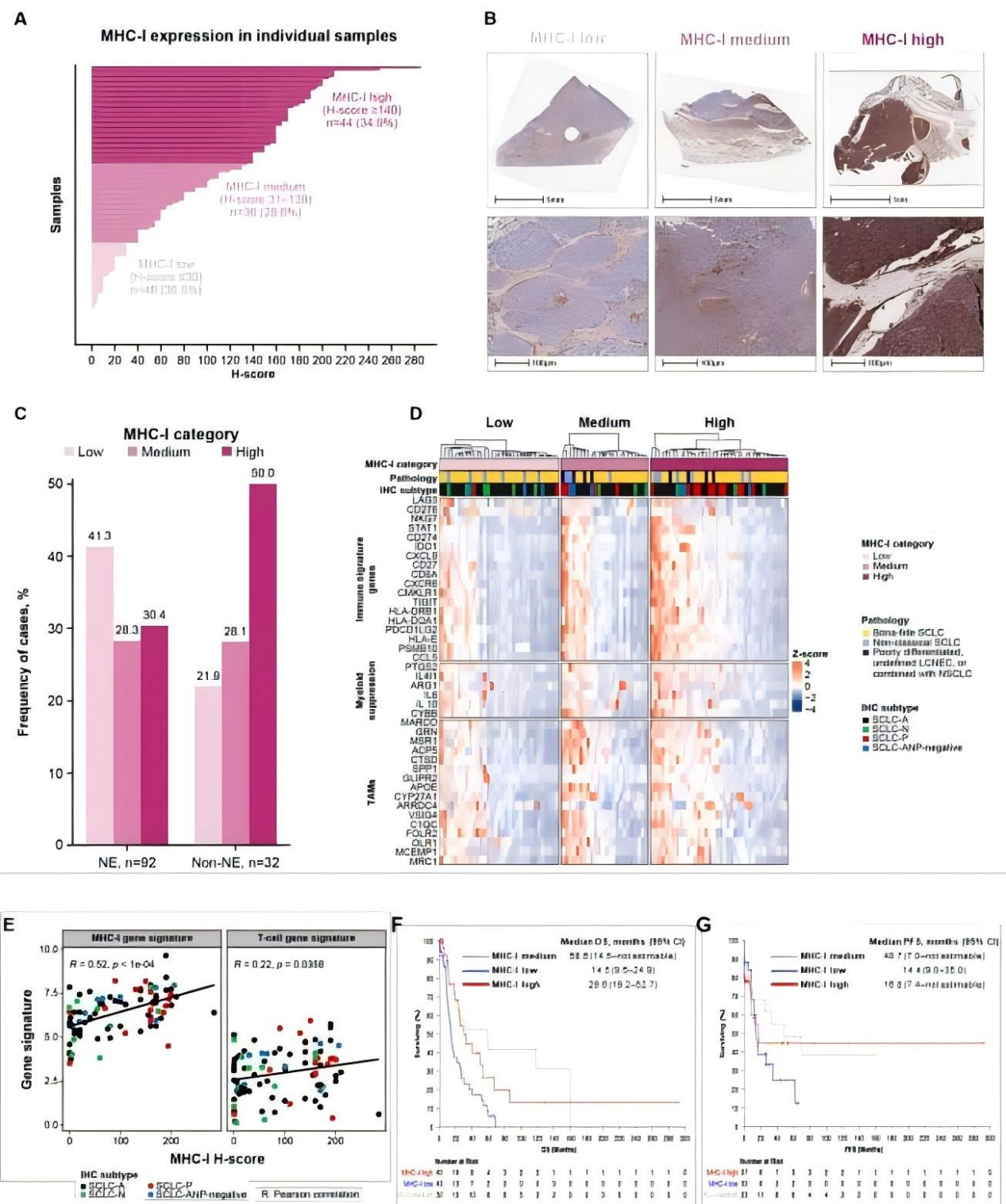
Fig.3 MHC-I高表达关联非神经内分泌亚型与免疫浸润
3. MHC-I驱动活化T细胞向肿瘤核心募集
为了深入理解MHC-I的功能机制,通过多重免疫荧光发现,MHC-I高表达重塑了肿瘤微环境的空间结构(Fig.4A)。在MHC-I高表达样本中,CD8⁺ /PD-1⁺ /Ki67⁺ T细胞更接近肿瘤细胞(Fig.4B-C),且肿瘤实质内增殖性T细胞比例升高(Fig.4D),表明MHC-I介导的抗原识别可能驱动局部T细胞功能活化(Fig.4E),为理解SCLC免疫“热”与“冷”表型的形成机制提供了空间维度证据。
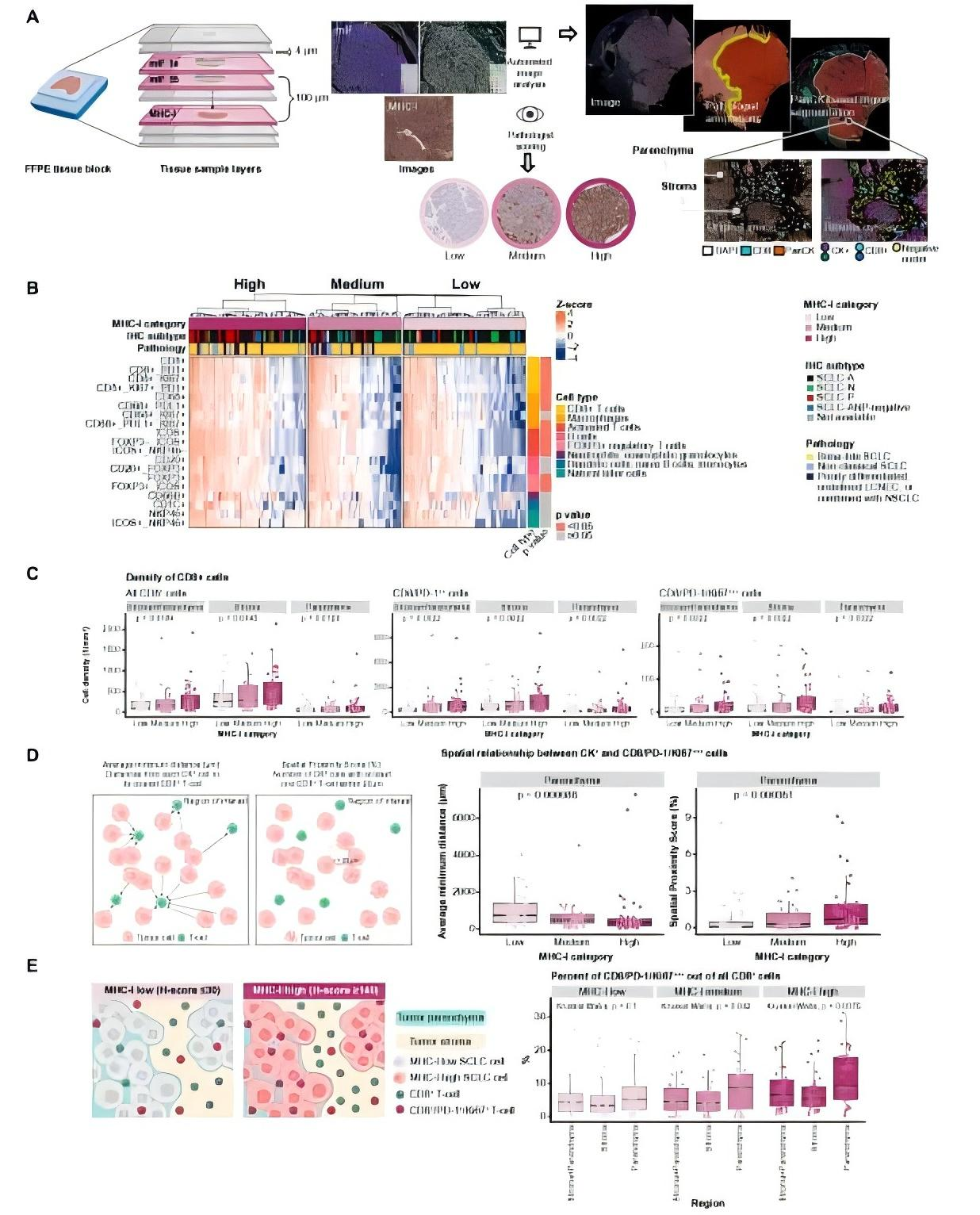
Fig.4 MHC-I驱动活化T细胞向肿瘤核心募集
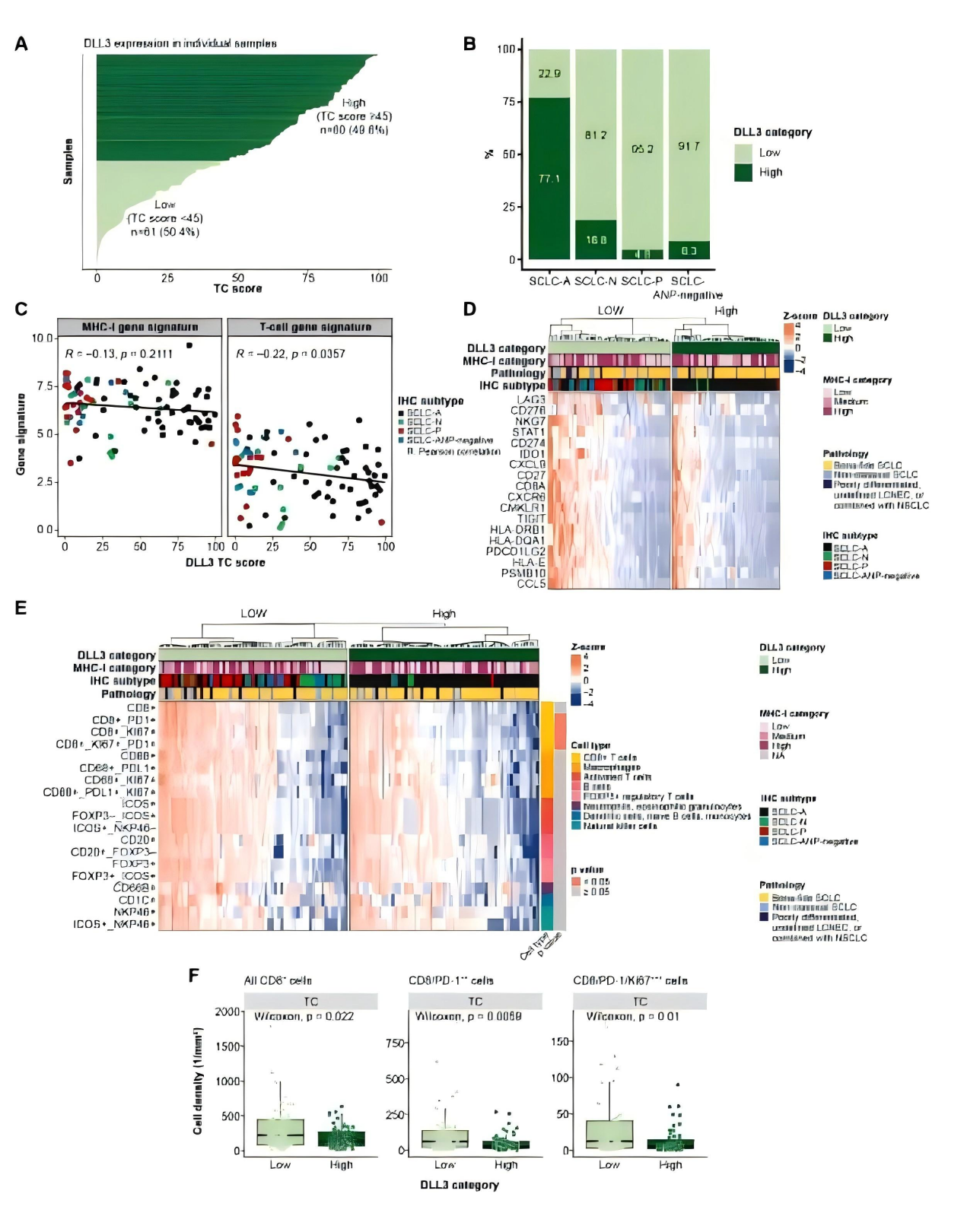
Fig.5 DLL3高表达富集于神经内分泌亚型并抑制免疫
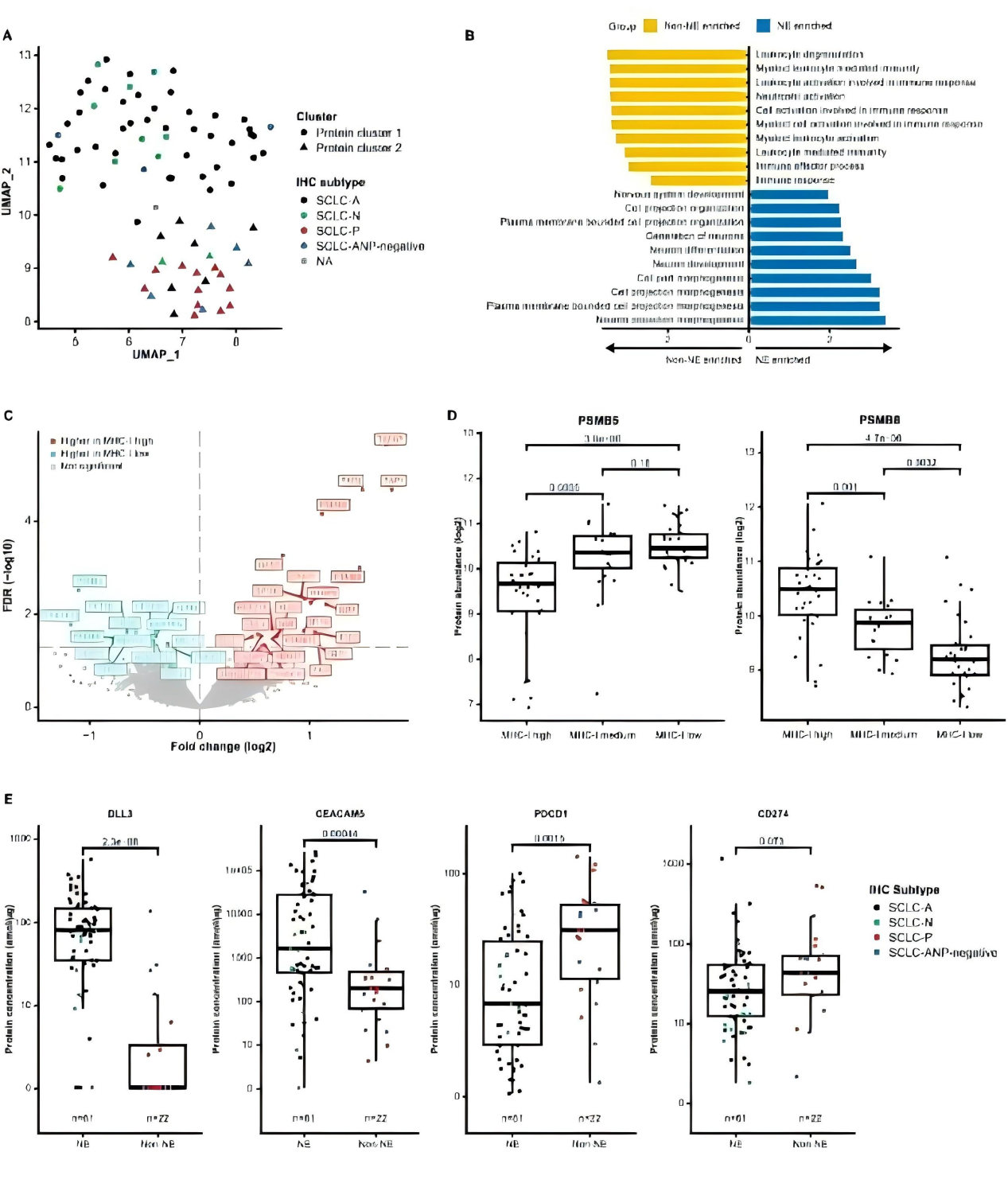
Fig.6 蛋白质组学揭示亚型特异性通路
文章总结
研究通过多组学分析,系统揭示了SCLC存在显著的分子亚型异质性,MHC-I在非神经内分泌亚型中高表达,并与肿瘤免疫浸润及免疫细胞空间分布相关,为其作为免疫治疗生物标志物提供机制支持。DLL3高表达多见于神经内分泌亚型,与“免疫冷”微环境相关,提示其靶向治疗需结合免疫背景进行策略优化。这些发现为打破SCLC传统“一刀切”治疗模式提供了新思路。未来需在临床研究中验证MHC-I等生物标志物的预测价值,并探索靶向DLL3的免疫疗法与现有治疗方案的联合策略。
原文链接:https://doi.org/10.1186/s12943-025-02514-4
研究背景
小细胞肺癌(SCLC)约占肺癌的15%,具有侵袭性强、转移率高的特点,多数患者确诊时已处晚期。尽管采用标准化疗联合免疫治疗,其3年生存率仍不足20%。核心问题是抗原呈递机制受抑、免疫细胞浸润少,导致免疫检查点抑制剂(ICB)响应有限。SCLC基因层面相对同质,缺乏经典可成药驱动基因,且肿瘤标本获取困难,限制了靶向治疗和生物标志物开发。虽已基于转录因子划分为A、N、P、I等亚型,但仍需更可靠的免疫治疗应答预测标志物。
2025年12月2日,阿斯利康全球多部门与德克萨斯大学MD安德森癌症中心的团队在Molecular Cancer上联合发表了题为“Multi-omic profiling provides insights into the heterogeneity, microenvironmental features, and biomarker landscape of small-cell lung cancer”的研究。该研究对159例未经系统治疗的SCLC切除组织,通过多组学整合分析,系统解析了SCLC的分子异质性、免疫微环境特征及潜在生物标志物,尤其聚焦于MHC-I表达与免疫细胞空间分布的关系,为理解SCLC生物学复杂性及指导免疫治疗提供了新的见解。

文章标题
实验设计
样本队列:159例未经系统治疗的SCLC患者的福尔马林固定石蜡包埋(FFPE)肿瘤手术切除样本。
关键特征:疾病分期涵盖I–IV期,所有样本采集于免疫治疗前(2001-2018年),避免了治疗对分子特征的干扰。
技术方法:利用多组学(基因、表观、转录、蛋白组)发现规律,利用免疫组织化学(IHC)和多重免疫荧光(mIF)进行验证和空间定位。

Fig.1 整体实验设计流程
研究结果
1. 多组学分析揭示SCLC分子亚型高度异质
研究首先通过对159例SCLC患者的多组学数据整合分析,确立了SCLC的分子亚型分类框架(Fig.2A)。神经内分泌亚型(SCLC-A/N)以ASCL1和NEUROD1高表达为特征,而非神经内分泌亚型(SCLC-P/ANP-negative)高表达POU2F3(Fig.2B-C)。值得注意的是,IHC与RNA-seq亚型分类在约15%的样本中存在不一致性,且免疫相关基因在非神经内分泌亚型中特异性富集(Fig.2D-E),提示亚型特异性通路激活是SCLC异质性的核心特征。

Fig.2 多组学分析揭示SCLC分子亚型高度异质
2. MHC-I高表达关联非神经内分泌亚型与免疫浸润

Fig.3 MHC-I高表达关联非神经内分泌亚型与免疫浸润
3. MHC-I驱动活化T细胞向肿瘤核心募集
为了深入理解MHC-I的功能机制,通过多重免疫荧光发现,MHC-I高表达重塑了肿瘤微环境的空间结构(Fig.4A)。在MHC-I高表达样本中,CD8⁺ /PD-1⁺ /Ki67⁺ T细胞更接近肿瘤细胞(Fig.4B-C),且肿瘤实质内增殖性T细胞比例升高(Fig.4D),表明MHC-I介导的抗原识别可能驱动局部T细胞功能活化(Fig.4E),为理解SCLC免疫“热”与“冷”表型的形成机制提供了空间维度证据。

Fig.4 MHC-I驱动活化T细胞向肿瘤核心募集

Fig.5 DLL3高表达富集于神经内分泌亚型并抑制免疫

Fig.6 蛋白质组学揭示亚型特异性通路
文章总结
研究通过多组学分析,系统揭示了SCLC存在显著的分子亚型异质性,MHC-I在非神经内分泌亚型中高表达,并与肿瘤免疫浸润及免疫细胞空间分布相关,为其作为免疫治疗生物标志物提供机制支持。DLL3高表达多见于神经内分泌亚型,与“免疫冷”微环境相关,提示其靶向治疗需结合免疫背景进行策略优化。这些发现为打破SCLC传统“一刀切”治疗模式提供了新思路。未来需在临床研究中验证MHC-I等生物标志物的预测价值,并探索靶向DLL3的免疫疗法与现有治疗方案的联合策略。
原文链接:https://doi.org/10.1186/s12943-025-02514-4