5月31日和6月1日,华盛顿大学 Michael J. MacCoss 团队[1] 和马克斯·普朗克生物化学研究所 Matthias Mann 团队[2] 先后在 bioRxiv 发表了两篇关于最新质谱仪 Orbitrap Astral Zoom 的预印本文章。


两篇预印本文章共同展示了 Orbitrap Astral Zoom 质谱仪在定量蛋白质组学中的前沿性能:
第一篇MacCoss团队的文章,重点在于 Orbitrap Astral Zoom 原型的性能验证与标准化度量方法建立。研究系统评估了其在采样效率、定量精度和跨平台可比性方面的优势,并引入 “离子数/秒” (ions/sec)的新标准化指标(即每秒钟被检测到的离子数量,这是研究团队提出的新性能指标);
第二篇Mann团队的文章,重点在于利用Astral的硬件优势开发nanoPhos流程,实现前所未有的空间磷酸化蛋白质组学。该方法支持纳克级别进样、细胞类型区分、组织微环境层次的信号通路定量分析,是一次典型的 “从硬件能力走向应用创新” 的研究范例。
这两篇预印本,一篇做底层标准(MacCoss团队),一篇做上层应用(Mann团队),分别从技术基础与生物学问题两个维度展示了 Orbitrap Astral Zoom 质谱平台的广阔潜力,也体现了质谱发展进入高通量 + 空间分辨 + 超低载量的融合阶段。
MacCoss 团队预印本文章

研究系统评估了最新的 Orbitrap Astral Zoom 质谱仪在定量蛋白质组学中的性能,重点在于其对传统 Orbitrap Astral MS的性能提升,并提出了一种统一的离子计数校准框架,以实现跨平台、跨实验的可比性。
文章指出,当前质谱仪器的性能评估仍多依赖于肽段和蛋白识别数量,缺乏对仪器核心参数如离子采样效率、定量精度等方面的量化标准。为此,研究团队通过推导基于泊松噪声(Poisson noise)的数学模型,将质谱信号强度转换为实际的 “离子/秒”(ions/sec)单位,建立了一种通用校准方法,并整合至Skyline分析平台,增加了多个新的离子计数指标,提升了数据解读能力。
实验方面,研究人员使用HeLa细胞裂解液与人源细胞外囊泡来源的肽段样本,在不同肽段进样量和DIA方法下,对两台仪器进行了系统对比。结果显示,Orbitrap Astral Zoom 在采集速率(acquisition rate)、传输时间(acquisition overhead)、循环时间(cycle time)等核心性能指标上均优于标准版本,尤其在高通量DIA模式下更具优势。
在肽段和蛋白识别方面,Orbitrap Astral Zoom 在所有进样量条件下均实现更多的识别数量,且在高进样量时差异尤为显著。在定量重复性方面,其在肽段和蛋白层面的变异系数(CV)均更低,显示出更高的精度和稳定性。
进一步的离子计数分析表明,Orbitrap Astral Zoom 在每个肽段上平均采集的离子数量明显高于标准仪器,尤其在低进样量或低丰度肽段中提升显著,增强了检测灵敏度和定量准确性。通过对标准肽段(如Glu-fibrinopeptide B)和校准混合物(Ultramark)进行实验,研究人员验证了该校准方法的通用性和准确性,并量化了各型号仪器的校准因子,进一步强化了结果的可比较性。
在人源细胞外囊泡来源的肽段样本的稀释曲线实验中,Orbitrap Astral Zoom 同样表现出更优的蛋白覆盖度、更高的离子采样量和更线性的定量能力,进一步验证了其在复杂生物背景下的实用性。
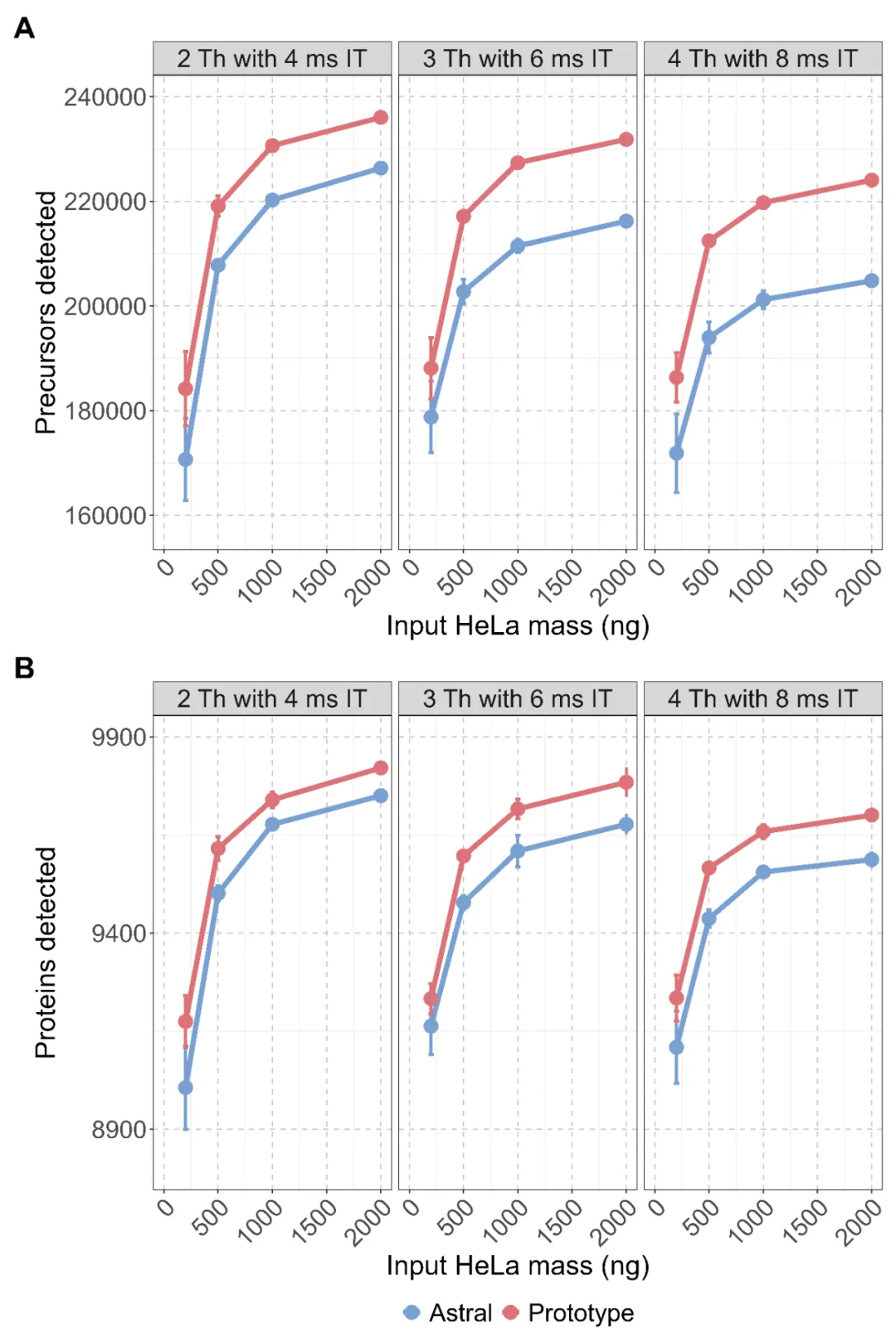
Orbitrap Astral Zoom 质谱原型机在较高进样量下提升了不同DIA isolation windows 条件下的前体肽段与蛋白识别数量。图 (B) 显示平均蛋白鉴定数,红色表示 Orbitrap Astral Zoom 原型机,蓝色表示标准 Orbitrap Astral 质谱仪。
整体而言,研究不仅验证了 Astral Zoom 在硬件层面的显著改进,也通过构建标准化的离子计数框架,推动了质谱仪性能评估从 “识别数量” 向 “采样效率和离子计数” 这一更科学、量化的方向转变。这对未来仪器研发、定量蛋白质组学研究乃至单细胞分析均具有重要意义。
Mann 团队预印本文章

研究介绍了一种新型的超高灵敏度空间磷酸化蛋白质组分析技术平台——nanoPhos,它显著提升了磷酸化蛋白检测的灵敏度和空间分辨率,尤其适用于微量样本、组织切片及单细胞级别的分析。
相比传统方法,nanoPhos 通过固相萃取捕获(SPEC)微反应体系与零体积损失的磷酸肽富集流程,实现了纳克级输入下的高通量、高覆盖磷酸化分析,突破了现有技术在样本处理体积、富集效率和数据质量方面的限制。
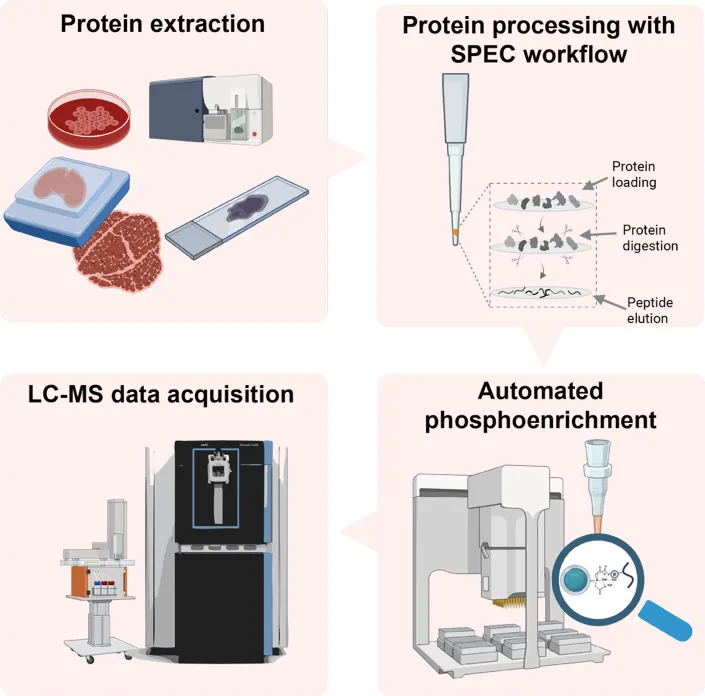
Design of the nanoPhos workflow
研究人员系统评估了nanoPhos的性能。在HeLa细胞裂解液稀释实验中,仅用10 ng进样量便能检测出逾8,000个磷酸化位点,远超µPhos在相同条件下的检测能力(约提升百倍)。此外,通过FACS(fluorescent-activated cell sorting,荧光细胞激活分选)筛选的少量细胞(如 100 个细胞)也可检测到数千个关键磷酸化位点,展现出极高的灵敏度和定量准确性。更重要的是,nanoPhos 在整个输入梯度中保持了高磷酸肽选择性(>82%)和良好的定量重现性(R² ~0.9)。
在功能验证方面,研究团队采用经典的EGF(表皮生长因子)刺激系统进行信号通路激活分析,即使在10 ng进样量下也可识别数百个显著上调的磷酸化位点,涵盖 EGFR、MAPK 等核心信号因子,且变化趋势与已有生物学认知一致,表明 nanoPhos 在低输入条件下仍具出色的动态响应能力。
更具突破意义的是,nanoPhos 成功应用于 FFPE 和冷冻脑组织样本,并与 Deep Visual Proteomics(DVP)技术整合,首次实现了细胞类型分辨与空间定位相结合的磷酸化蛋白质组图谱(phosphoDVP)。例如,从仅约40个皮层神经元形态中便可获得上千个磷酸化位点,在1,000个细胞形态输入时可达到经典蛋白质组学深度(>17,000 位点)。分析还揭示了兴奋性与抑制性神经元、皮层与皮层下区域在突触调控等功能上的磷酸化差异,如兴奋性神经元中 Shank1 和 NTRK1 通路的特异激活。
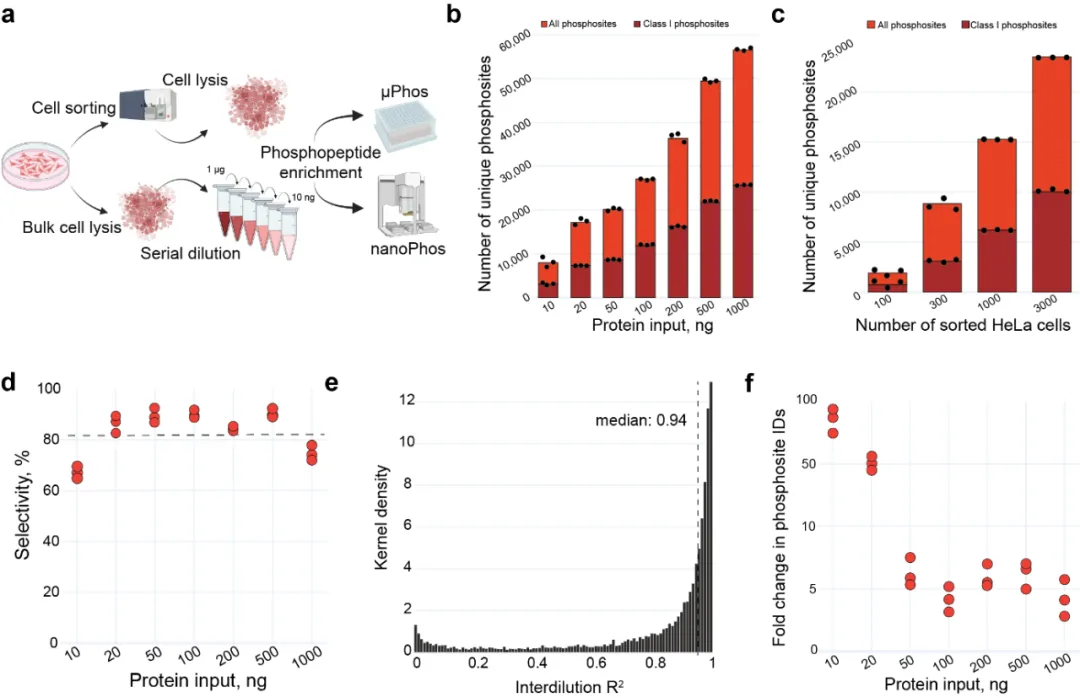
Benchmarking nanoPhos sensitivity and quantitative performance
总之,nanoPhos 打破了磷酸化蛋白组学对样本量的依赖,开启了 “纳克级别、细胞分型、空间定位” 三重维度整合的研究新范式。其在神经科学、癌症微环境、药物作用机制及 FFPE 组织再利用等方面均具有广泛应用前景。
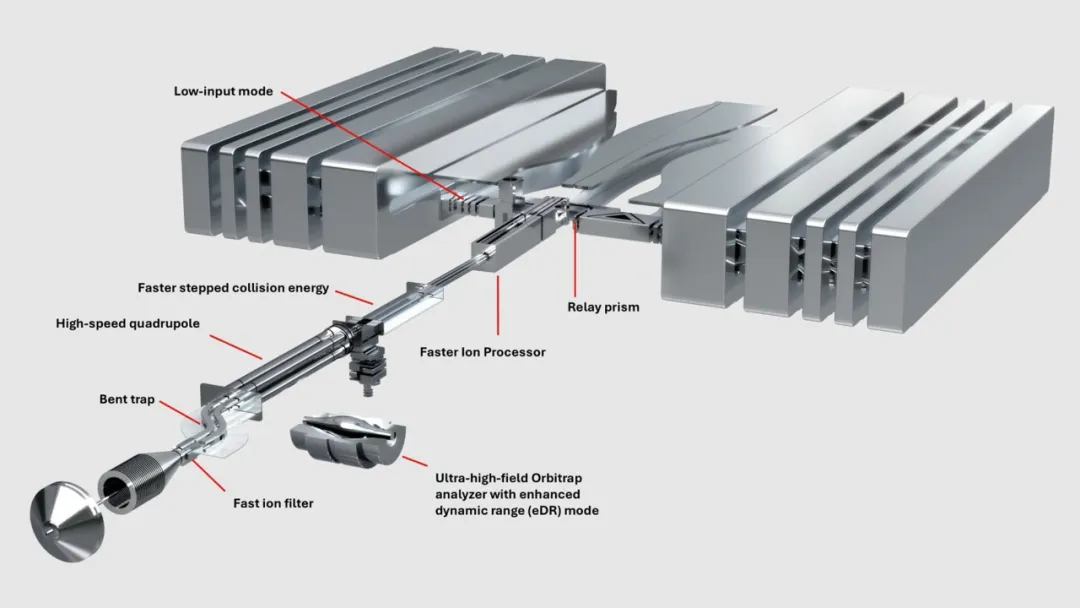
Orbitrap Astral Zoom Mass Spectrometer architecture, cr: thermofisher.com
论文链接:
1. https://www.biorxiv.org/content/10.1101/2025.05.30.657132v2
2. https://www.biorxiv.org/content/10.1101/2025.05.29.656770v1