
2025年9月14日,暨南大学生命科学与技术学院张志毅课题组与中山大学肿瘤防治中心研究团队在 Journal of advanced research 上发表了题为“Integrative proteomic characterization of human lung adenocarcinoma with KRAS G12 mutations reveals molecular pathogenesis” 的最新研究成果。
该研究通过9479例泛癌队列(其中3523例肺癌)构建KRAS变异及其相互作用的基因组图谱(NGS);随后对96名LUAD患者样本(包括KRAS G12突变和野生型)进行LC-MS/MS蛋白质组学分析,揭示了与KRAS G12突变相关的蛋白质变化。之后通过多重免疫组化(mIHC)评估TIME,研究不同KRAS突变类型对免疫细胞浸润的影响,外加近邻标记互作蛋白组定位KRAS G12各突变类型的潜在效应分子,旨在回答:KRAS G12(尤其 G12C)如何重塑蛋白网络与免疫微环境,并据此实现可转化的分层与靶点开发。
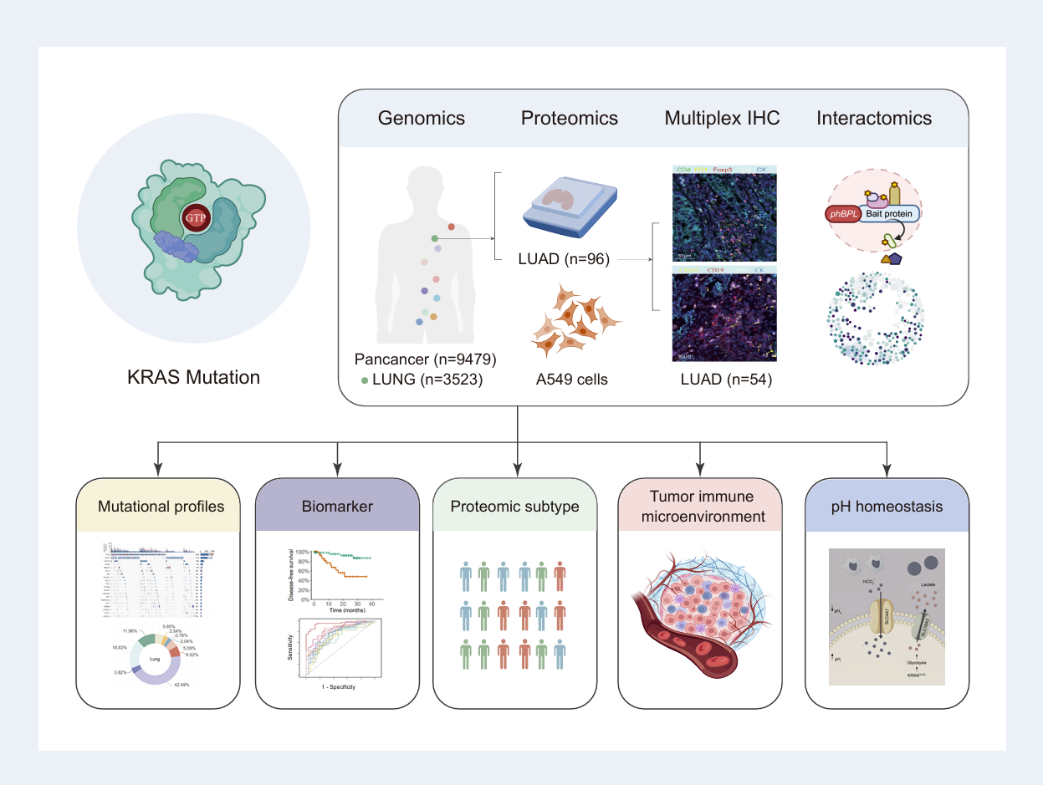
图形摘要
01 KRAS基因突变谱
基于SYSUCC队列(本次研究队列),最常突变为TP53(62.2%),随后是KRAS(23.9%)、APC(23.8%)与EGFR(22.0%);在肺癌中则以TP53 59.0%、EGFR 51.0%、LRP1B 16.1%与KRAS 10.6%为特征(Fig1 A),且中国人群TP53突变率显著高于MSKCC队列(美国斯隆凯特琳癌症中心,p=0.009,Fig1 B)。此外,KRAS突变亚型呈现差异:肺癌以G12C最突出,而在泛癌层面G12D/G12V/G13D更常见(Fig1 C);通路关系上KRAS与EGFR明显互斥(SELECT:肺癌41个相互作用,含33个互斥),而KRAS与TP53未见显著互作(Fig1 D)。与KRAS状态相关的高频伴随改变包括LRP1B、STK11、KEAP1、ATM等。等位基因层面,G12C富集LRP1B/RBM10/KEAP1/STK11,而G12D/G12V更偏PIK3CA/PIK3CG/NKX2-1/TERT/SETBP1等;多抑制子(如TP53/LRP1B/STK11)联合突变在KRAS突变肿瘤更常见,且较少见于G12C(Fig1 E)。临床关联方面,肿瘤突变负荷(TMB)在KRAS-MUT(野生型/突变型)尤其G12C最高(Fig1 F),微卫星高不稳定(MSI-H)略增且主要见于G12D(Fig1 G);生存上KRAS WT(野生型/突变型)优于MUT(肺癌中位DFS 58.7 vs 40.1月, Fig1 H)。
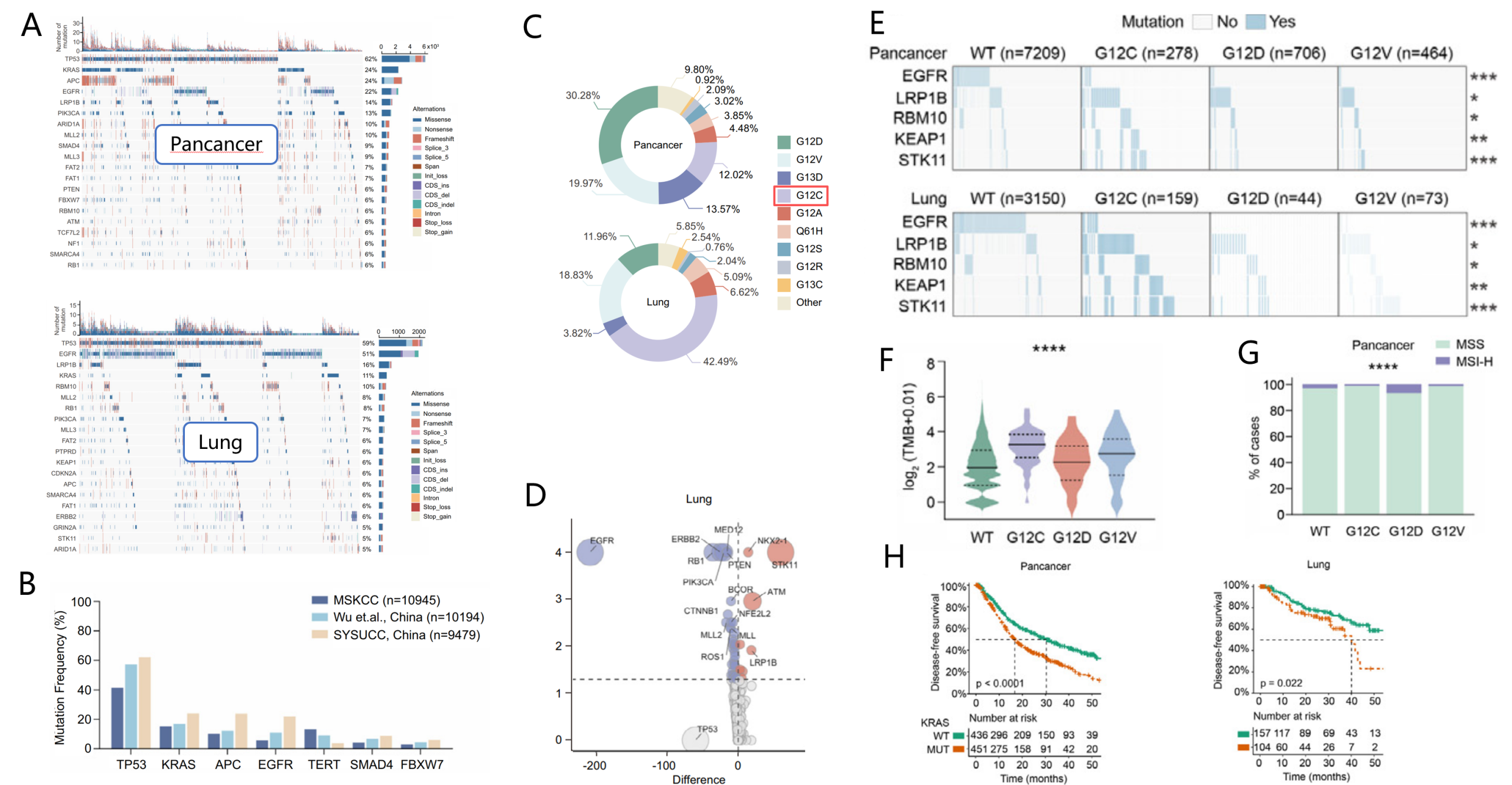
Figure 1

Figure 2
03 KRAS G12突变特征蛋白及基于蛋白组的分子分型
进一步,他们从KRAS WT/G12C/G12D/G12V四组中筛出609个“特征蛋白”(WT组260个、G12C组154个、G12D组138个、G12V组57个,Fig3 A)。通过GSEA富集分析发现WT组以代谢相关蛋白为主,而G12C组显著激活免疫相关通路(Fig3 B)。多种蛋白与预后显著相关(如CRYM/GLS保护;CTSD/CPS1/NOP2风险,Fig3 C),这些表达模式在FFPE组织、细胞蛋白组与外部临床蛋白组中得到验证(Fig3 D)。
随后,团队对96例样本进行无监督聚类得到三种蛋白质组亚型S1=48,S2=34,S3=14,其中S2亚型预后最差(Fig3 E、F)。GO富集分析显示,S1代谢/黏附异常、以早期病灶和野生型KRAS/TP53为主;S2免疫调节型;S3激素代谢紊乱/蛋白糖基化(Fig3 G)。且PLOD2、CTSL、MSR1、MMP12、TREM1在S2上调并能高准确度识别S2,具备分层与预测潜力(Fig3 H)。
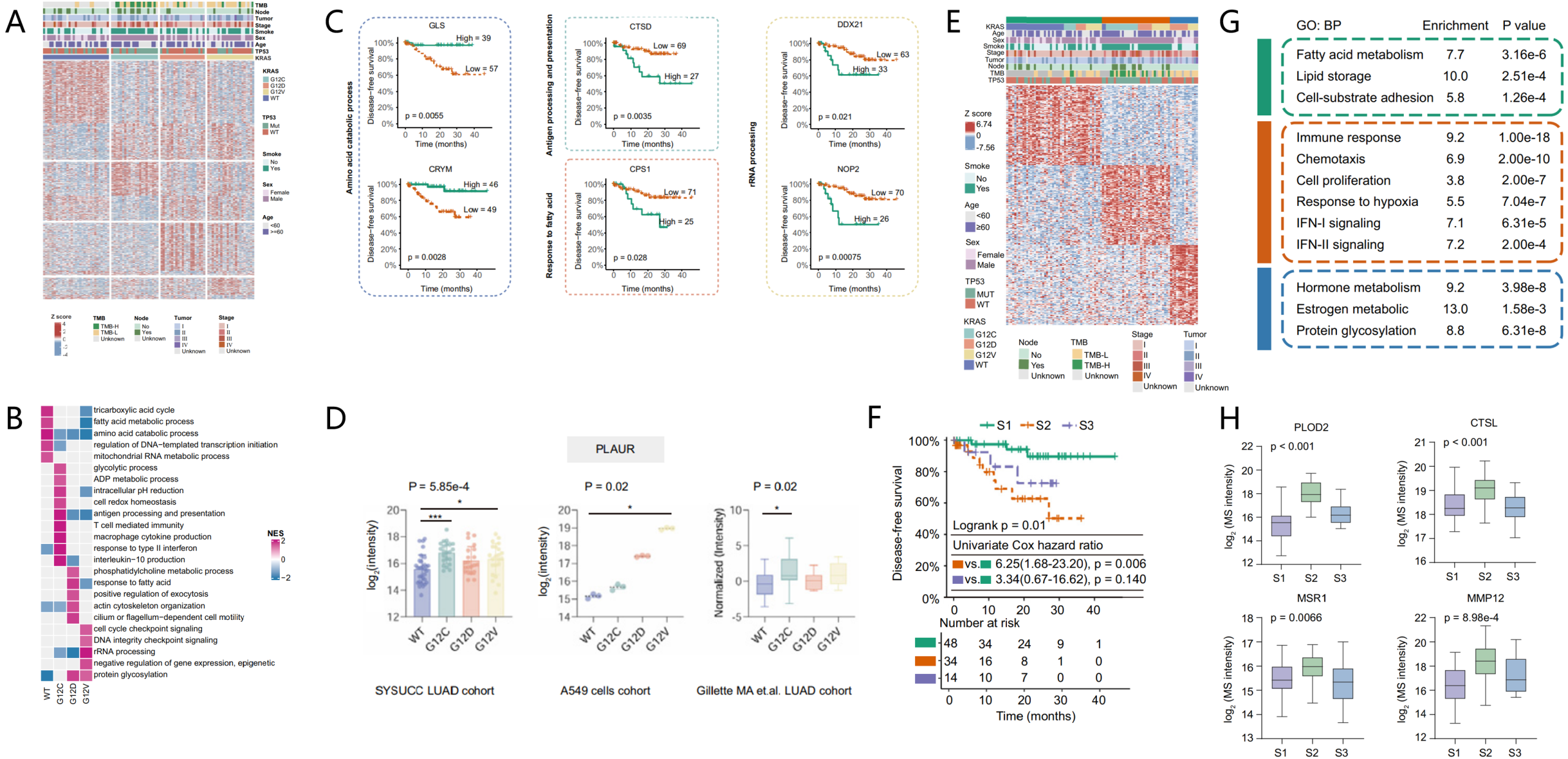
Figure 3
04 KRAS G12突变LUAD患者的肿瘤免疫微环境图谱
基于对54例LUAD切片的多重免疫荧光(mIHC),研究者进一步系统刻画了KRAS G12突变对肿瘤免疫微环境(TIME)的影响(Fig4 A):G12C患者肿瘤内CD8⁺、PD1⁺、CD68⁺(含M2:CD68⁺CD163⁺)浸润更高;S2亚型(免疫调节型)浸润最强;KRAS×TP53共突变可进一步放大CD8⁺T与巨噬细胞的浸润,而仅TP53突变的样本最低(Fig4 B)。相关网络显示,CD8⁺PD1⁺与“预后特征蛋白”的耦合最强,B细胞(CD19⁺)最弱(Fig4 C);在分组对比中,WT的蛋白–免疫相关网络更“致密”,提示不同KRAS背景下TIME的调控轴不同,为理解G12C的免疫学表型及后续免疫治疗分层提供了依据(Fig4 D)。

Figure 4
04 KRAS邻近蛋白质组学揭示SLC4A7-乳酸轴连接代谢与免疫抑制机制
本文作者构建了基于快速邻近标记的蛋白质组学流程PhastID,在不改变KRAS定位与致癌性的前提下,于HEK293中稳定表达phBPL-KRAS,系统绘制突变KRAS的邻近相互作用蛋白组:每个等位基因识别245~436个互作蛋白、合计528个非冗余蛋白,约45%为文献已知,G12V的互作显著减少(Fig5 A)。等位基因特异分析显示共同涉及多条致癌通路,而G12C特异富集离子转运体(如SLC12A2、SLC4A7,Fig5 B、C)。SLC4A7与KRAS-G12C直接互作并在G12C肿瘤上调,其表达与细胞系乳酸水平正相关,敲低可致乳酸在胞内积聚;同时SLC16A3在G12C上调并与SLC4A7强相关。由此提出模型:KRAS→mTORC1↑→糖酵解↑→乳酸↑;SLC4A7(协同SLC16A3)促乳酸外排,造成“胞内碱化/胞外酸化”的酸性TIME(Fig5 D)。
mIHC显示SLC4A7高伴随CD8⁺PD1⁺T和CD68⁺CD163⁺M2浸润升高;公开NSCLC队列中PD-1应答者SLC4A7更高;药物S0859抑制SLC4A7会扰动免疫相关基因表达(Fig5 E)。临床上,SLC4A7高表达→DFS更差;SLC16A3单独不显著,但SLC4A7+SLC16A3双高预后最差,提示二者在塑造免疫抑制、代谢有利的微环境中具有协同作用并具备联合干预与分层标志物潜力(Fig5 F)。

Figure 5

2025年9月14日,暨南大学生命科学与技术学院张志毅课题组与中山大学肿瘤防治中心研究团队在 Journal of advanced research 上发表了题为“Integrative proteomic characterization of human lung adenocarcinoma with KRAS G12 mutations reveals molecular pathogenesis” 的最新研究成果。
该研究通过9479例泛癌队列(其中3523例肺癌)构建KRAS变异及其相互作用的基因组图谱(NGS);随后对96名LUAD患者样本(包括KRAS G12突变和野生型)进行LC-MS/MS蛋白质组学分析,揭示了与KRAS G12突变相关的蛋白质变化。之后通过多重免疫组化(mIHC)评估TIME,研究不同KRAS突变类型对免疫细胞浸润的影响,外加近邻标记互作蛋白组定位KRAS G12各突变类型的潜在效应分子,旨在回答:KRAS G12(尤其 G12C)如何重塑蛋白网络与免疫微环境,并据此实现可转化的分层与靶点开发。

图形摘要
01 KRAS基因突变谱
基于SYSUCC队列(本次研究队列),最常突变为TP53(62.2%),随后是KRAS(23.9%)、APC(23.8%)与EGFR(22.0%);在肺癌中则以TP53 59.0%、EGFR 51.0%、LRP1B 16.1%与KRAS 10.6%为特征(Fig1 A),且中国人群TP53突变率显著高于MSKCC队列(美国斯隆凯特琳癌症中心,p=0.009,Fig1 B)。此外,KRAS突变亚型呈现差异:肺癌以G12C最突出,而在泛癌层面G12D/G12V/G13D更常见(Fig1 C);通路关系上KRAS与EGFR明显互斥(SELECT:肺癌41个相互作用,含33个互斥),而KRAS与TP53未见显著互作(Fig1 D)。与KRAS状态相关的高频伴随改变包括LRP1B、STK11、KEAP1、ATM等。等位基因层面,G12C富集LRP1B/RBM10/KEAP1/STK11,而G12D/G12V更偏PIK3CA/PIK3CG/NKX2-1/TERT/SETBP1等;多抑制子(如TP53/LRP1B/STK11)联合突变在KRAS突变肿瘤更常见,且较少见于G12C(Fig1 E)。临床关联方面,肿瘤突变负荷(TMB)在KRAS-MUT(野生型/突变型)尤其G12C最高(Fig1 F),微卫星高不稳定(MSI-H)略增且主要见于G12D(Fig1 G);生存上KRAS WT(野生型/突变型)优于MUT(肺癌中位DFS 58.7 vs 40.1月, Fig1 H)。

Figure 1

Figure 2
03 KRAS G12突变特征蛋白及基于蛋白组的分子分型
进一步,他们从KRAS WT/G12C/G12D/G12V四组中筛出609个“特征蛋白”(WT组260个、G12C组154个、G12D组138个、G12V组57个,Fig3 A)。通过GSEA富集分析发现WT组以代谢相关蛋白为主,而G12C组显著激活免疫相关通路(Fig3 B)。多种蛋白与预后显著相关(如CRYM/GLS保护;CTSD/CPS1/NOP2风险,Fig3 C),这些表达模式在FFPE组织、细胞蛋白组与外部临床蛋白组中得到验证(Fig3 D)。
随后,团队对96例样本进行无监督聚类得到三种蛋白质组亚型S1=48,S2=34,S3=14,其中S2亚型预后最差(Fig3 E、F)。GO富集分析显示,S1代谢/黏附异常、以早期病灶和野生型KRAS/TP53为主;S2免疫调节型;S3激素代谢紊乱/蛋白糖基化(Fig3 G)。且PLOD2、CTSL、MSR1、MMP12、TREM1在S2上调并能高准确度识别S2,具备分层与预测潜力(Fig3 H)。

Figure 3
04 KRAS G12突变LUAD患者的肿瘤免疫微环境图谱
基于对54例LUAD切片的多重免疫荧光(mIHC),研究者进一步系统刻画了KRAS G12突变对肿瘤免疫微环境(TIME)的影响(Fig4 A):G12C患者肿瘤内CD8⁺、PD1⁺、CD68⁺(含M2:CD68⁺CD163⁺)浸润更高;S2亚型(免疫调节型)浸润最强;KRAS×TP53共突变可进一步放大CD8⁺T与巨噬细胞的浸润,而仅TP53突变的样本最低(Fig4 B)。相关网络显示,CD8⁺PD1⁺与“预后特征蛋白”的耦合最强,B细胞(CD19⁺)最弱(Fig4 C);在分组对比中,WT的蛋白–免疫相关网络更“致密”,提示不同KRAS背景下TIME的调控轴不同,为理解G12C的免疫学表型及后续免疫治疗分层提供了依据(Fig4 D)。

Figure 4
04 KRAS邻近蛋白质组学揭示SLC4A7-乳酸轴连接代谢与免疫抑制机制
本文作者构建了基于快速邻近标记的蛋白质组学流程PhastID,在不改变KRAS定位与致癌性的前提下,于HEK293中稳定表达phBPL-KRAS,系统绘制突变KRAS的邻近相互作用蛋白组:每个等位基因识别245~436个互作蛋白、合计528个非冗余蛋白,约45%为文献已知,G12V的互作显著减少(Fig5 A)。等位基因特异分析显示共同涉及多条致癌通路,而G12C特异富集离子转运体(如SLC12A2、SLC4A7,Fig5 B、C)。SLC4A7与KRAS-G12C直接互作并在G12C肿瘤上调,其表达与细胞系乳酸水平正相关,敲低可致乳酸在胞内积聚;同时SLC16A3在G12C上调并与SLC4A7强相关。由此提出模型:KRAS→mTORC1↑→糖酵解↑→乳酸↑;SLC4A7(协同SLC16A3)促乳酸外排,造成“胞内碱化/胞外酸化”的酸性TIME(Fig5 D)。
mIHC显示SLC4A7高伴随CD8⁺PD1⁺T和CD68⁺CD163⁺M2浸润升高;公开NSCLC队列中PD-1应答者SLC4A7更高;药物S0859抑制SLC4A7会扰动免疫相关基因表达(Fig5 E)。临床上,SLC4A7高表达→DFS更差;SLC16A3单独不显著,但SLC4A7+SLC16A3双高预后最差,提示二者在塑造免疫抑制、代谢有利的微环境中具有协同作用并具备联合干预与分层标志物潜力(Fig5 F)。

Figure 5








