文献目录
01 (CANCER CELL) 多组学整合揭示致命第三亚型髓母细胞瘤中脂质依赖性的肿瘤异质性
02 (EUR HEART J) 蒽环类药物心脏毒性的机制:由心脏压力超负荷引起的代谢脆弱性的作用
03 (NAT REV ENDOCRINOL) 基于血液的肥胖生物标志物及其与疾病风险的相关性
04 (CELL METAB) 人类MASLD是一种昼夜性疾病,由多系统胰岛素抵抗和夜间胰岛素可用性降低驱动
05 (GUT) LY6D标识持续存在的干细胞样细胞,推动胰腺肿瘤发生
06 (ANN RHEUM DIS) I型干扰素内型驱动儿童期发病SLE的不同临床轨迹,通过一种新颖的系统免疫学方法揭示
07 (NUCLEIC ACIDS RES) 原代人类细胞类型的转录组和蛋白质组图谱
08 (CIRC RES) Apilimod通过抑制1-磷酸磷脂酰肌醇3-磷酸5-激酶促进血管平滑肌细胞的脂肪细胞样表型并防止动脉钙化
一起来看看本期的蛋白质组学精选优质文献吧!

1. (CANCER CELL,IF:48.8) 多组学整合揭示致命第三亚型髓母细胞瘤中脂质依赖性的肿瘤异质性
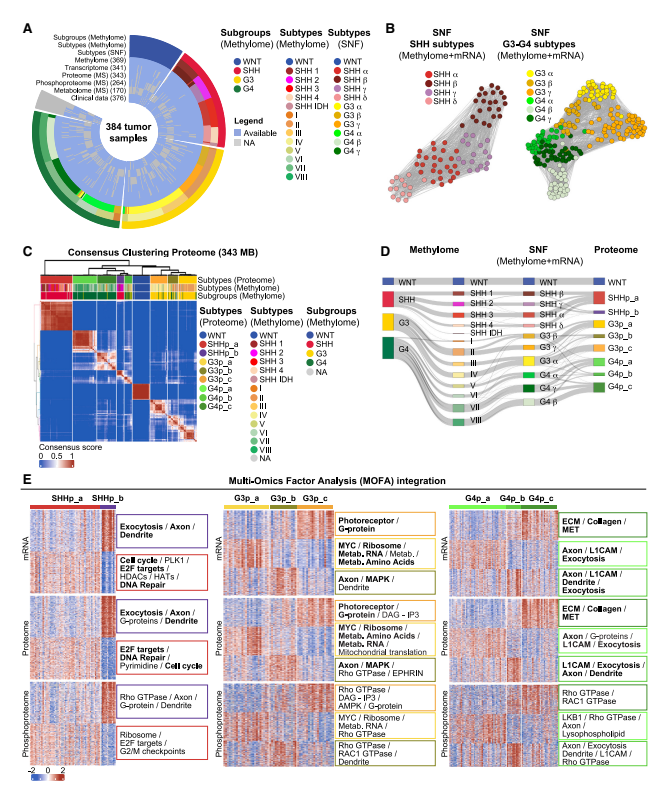
髓母细胞瘤是儿童最常见的恶性脑肿瘤,其中致死率极高的第3亚型(Group 3)研究迎来重要突破。2026年1月15日,Cancer Cell在线发表了一项大型多组学研究,团队整合分析了384例原发肿瘤样本的甲基化、转录组、蛋白质组、磷酸化蛋白质组及代谢组数据,系统揭示了肿瘤异质性背后的脂质代谢依赖机制。
通过蛋白质组学和磷酸化蛋白质组学分析,研究首次在蛋白水平证实MYC-FASN-SCD信号轴驱动脂质从头合成。然而,单纯抑制该通路会触发肿瘤细胞的代偿性逃逸——转而通过摄取外源性脂肪酸维持生存。
更关键的发现来自对脂滴-线粒体互作的蛋白质组学解析:MYC高表达不仅促进脂质合成,还诱导脂滴异常蓄积。肿瘤细胞形成独特的代谢依赖——必须依赖脂滴与线粒体之间的通讯来供能,这一机制在蛋白水平得到了精确验证。
该研究利用多组学整合策略,在蛋白质组层面锁定MYC下游的"脂质成瘾"弱点,为目前无有效治疗方案的Group 3髓母细胞瘤提供了精准干预新思路。研究证实靶向脂滴-线粒体互作可打破肿瘤代谢平衡,展现出良好的治疗开发前景。

2. (EUR HEART J,IF:37.6) 蒽环类药物心脏毒性的机制:由心脏压力超负荷引起的代谢脆弱性的作用
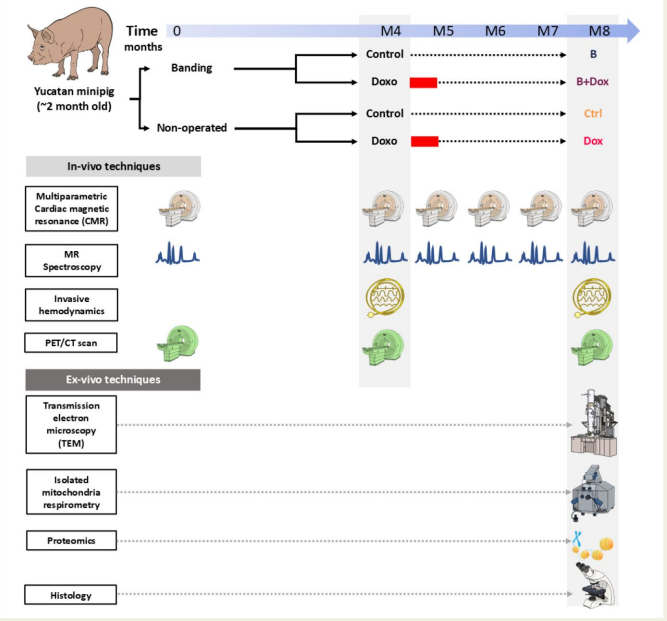
高血压和心脏瓣膜病增加蒽环类化疗药物心脏毒性的风险,但其分子机制长期不明。2025年12月,European Heart Journal发表了一项大型动物模型研究,通过蛋白质组学手段,首次系统阐明了左心室压力负荷如何通过代谢失衡诱发化疗心脏损伤。
研究采用尤卡坦小型猪模型,对四组动物(健康对照、单纯化疗、单纯主动脉缩窄、缩窄+化疗)进行长达8个月的纵向追踪。通过蛋白质组学分析,团队发现左心室压力负荷单独即可诱导三羧酸循环、钙信号及肌动蛋白细胞骨架调控相关蛋白簇显著上调,反映心肌处于高能量需求状态。此时心肌通过消耗磷酸肌酸储备维持ATP稳定,功能虽得以代偿,但形成"隐匿性代谢脆弱性"。
单纯低剂量化疗(多柔比星)虽未损害心功能,但蛋白质组学显示其已下调氧化磷酸化蛋白、上调糖酵解酶,提示代谢底物从脂肪酸向葡萄糖转换。当压力负荷与化疗双重打击时,蛋白质组学网络分析揭示线粒体呼吸链复合物I-V全面下调、糖酵解酶亦受抑制,心肌丧失能量供应能力,同时伴随细胞外基质重构和钙信号通路紊乱,最终导致心功能衰竭。
研究证实能量供需失衡是核心致病机制。体外实验中,使用肌球蛋白抑制剂mavacamten降低心肌能量需求,可显著挽救双重应激下的细胞存活率。这为高血压等压力负荷患者接受蒽环类化疗时的的心脏保护提供了可干预靶点,提示通过蛋白质组学指导的代谢调节策略具有重要临床价值。
https://academic.oup.com/eurheartj/advance-article/doi/10.1093/eurheartj/ehaf1060/8424139?login=true

3. (NAT REV ENDOCRINOL,IF:31.0) 基于血液的肥胖生物标志物及其与疾病风险的相关性
肥胖是2型糖尿病、心血管疾病和多种癌症的重要危险因素,但其分子机制尚未完全阐明。2026年,Nature Reviews Endocrinology发表综述,系统梳理了血液肥胖生物标志物的研究进展,特别强调了蛋白质组学技术在发现新型标志物中的关键作用。
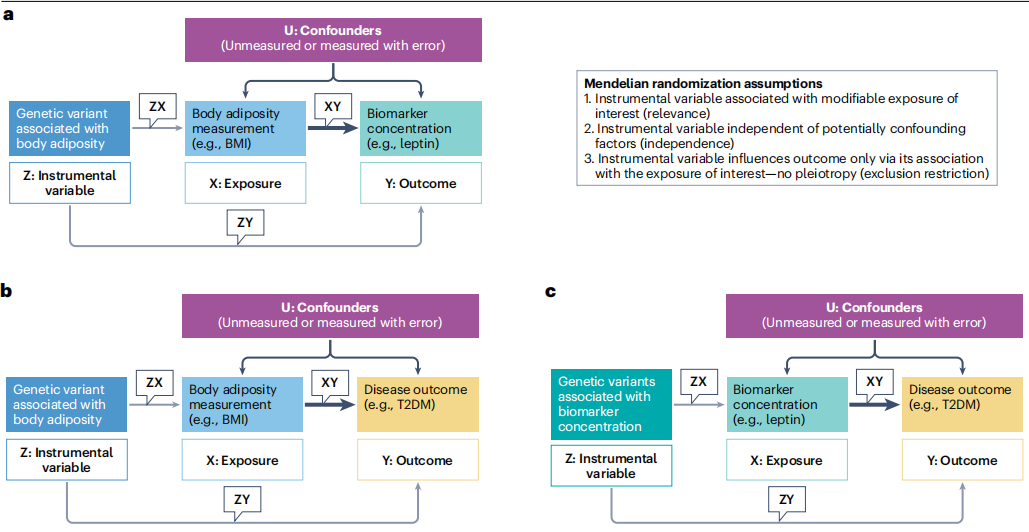
传统肥胖标志物如瘦素、脂肪酸结合蛋白4(FABP4)和白介素-6(IL-6)主要通过动物实验发现。近十年来,高通量蛋白质组学技术推动了人类观察性研究中的标志物发现。大规模队列研究(样本量>1,000)采用SomaScan和Olink等靶向蛋白质组学平台,不仅重新确认了瘦素、FABP4、IL-6等经典标志物与肥胖的因果关联,还发现了补体因子I(CFAI)、晚期糖基化终产物受体(RAGE)和Wnt-β-catenin通路负调控因子AXIN1等新型肥胖相关蛋白。
特别值得注意的是,一项纳入30,931人的蛋白质组学孟德尔随机化研究发现,肥胖遗传风险与32种血浆蛋白水平存在因果关联,其中RAGE水平受肥胖负向调控,并与2型糖尿病风险呈负相关、与前列腺癌风险呈正相关。另一项研究利用Olink高灵敏度免疫分析平台鉴定出21个蛋白组成的"肥胖相关炎症特征",可预测全因死亡、心脏死亡及主要心血管不良事件。
蛋白质组学研究揭示了肥胖与代谢疾病的蛋白网络关联,但不同平台间标准化不足、批次效应等问题仍待解决。未来需在大规模前瞻性队列中验证新型标志物的疾病预测价值,并探索其作为干预靶点的潜力。

4. (CELL METAB,IF:27.7) 人类MASLD是一种昼夜性疾病,由多系统胰岛素抵抗和夜间胰岛素可用性降低驱动
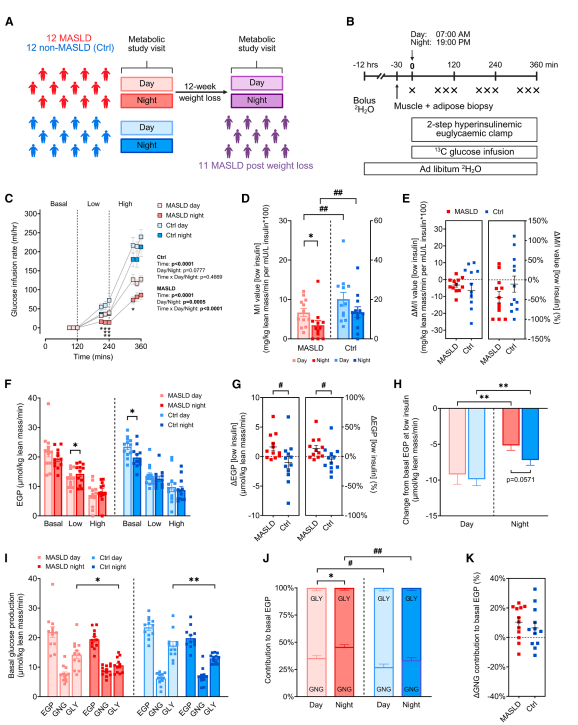
代谢功能障碍相关脂肪性肝病(MASLD)影响全球约40%人口,但其昼夜代谢特征长期不明。2026年3月3日,Cell Metabolism发表了一项临床研究,通过蛋白质组学手段,首次揭示MASLD是一种"夜间疾病"——患者在夜间表现出多系统胰岛素抵抗和代谢功能障碍。
研究团队对12例MASLD患者和12例对照进行昼夜代谢表型分析,采用Olink靶向蛋白质组学检测血浆中691种心血管代谢和炎症相关蛋白,并结合液相色谱-串联质谱(LC-MS/MS)对脂肪组织和骨骼肌进行非靶向蛋白质组学分析。
血浆蛋白质组学发现,MASLD患者夜间生长分化因子15(GDF-15)显著上调,而组织型纤溶酶原激活物(tPA)及其抑制剂PAI-1显著下调。GDF-15作为营养应激标志物,与β-氧化标志物3-羟基丁酸呈强正相关,提示其可能通过促进脂肪酸氧化发挥代偿保护作用。UK Biobank大样本验证(54,219人)证实了这些蛋白的昼夜节律模式,且MASLD患者GDF-15昼夜差异更为显著。
组织蛋白质组学进一步揭示:脂肪组织中二甲基精氨酸二甲胺水解酶1(DDAH1)夜间升高并与脂解标志物正相关;骨骼肌中蛋白质-异戊二烯半胱氨酸O-甲基转移酶(ICMT)夜间下调,该蛋白与葡萄糖处置率、胰岛素敏感性及丙酮酸氧化呈正相关,提示其可能通过调控Rac1信号影响外周葡萄糖摄取。
值得注意的是,即使经过12周减重干预、肝脏脂肪含量显著降低后,这些夜间代谢功能障碍仍持续存在,表明夜间代谢紊乱可能是MASLD的原发驱动因素而非继发现象。该研究为MASLD的时辰治疗策略——包括优化能量摄入时间、运动时段和药物递送窗口——提供了分子靶点和理论依据。

5. (Gut,IF:23.0) LY6D标识持续存在的干细胞样细胞,推动胰腺肿瘤发生
胰腺导管腺癌(PDAC)是恶性程度极高的肿瘤,其早期细胞异质性是驱动肿瘤进展的关键。2026年1月16日,Gut在线发表研究,通过单细胞RNA测序和TurboID邻近蛋白质组学技术,鉴定出LY6D作为PDAC早期促癌细胞状态的标志物。
研究团队首先整合公共及自有的单细胞测序数据,识别出LY6D+胃样细胞亚群在早期异质性中出现并持续存在于肿瘤发生全程。为阐明其分子机制,研究采用TurboID邻近蛋白质组学技术——利用抗坏血酸过氧化物酶(APEX2)标记LY6D蛋白的邻近互作网络。这一蛋白质组学方法成功捕获了LY6D作为糖基磷脂酰肌醇(GPI)锚定蛋白,在脂筏区域支架化激酶信号网络的功能。
该蛋白质组学分析揭示了LY6D通过脂筏相关激酶网络驱动FOSL1依赖的表观遗传-转录重编程,赋予细胞干性特征和独特的氧化磷酸化(OXPHOS)代谢依赖。遗传学实验证实,Ly6d敲除特异性损害胃样谱系并延迟肿瘤发生,而过表达则增强致瘤和转移潜能。
在人类PDAC队列中,LY6D+细胞富集干性和上皮-间质转化(EMT)特征,高LY6D表达是预后不良的独立标志物。该研究将蛋白质组学发现的LY6D+细胞状态定义为连接早期癌前异质性与PDAC发生进展的关键驱动因素,为PDAC的早期检测和全阶段治疗干预提供了新靶点和候选生物标志物。
原文链接: https://pubmed.ncbi.nlm.nih.gov/41545197/

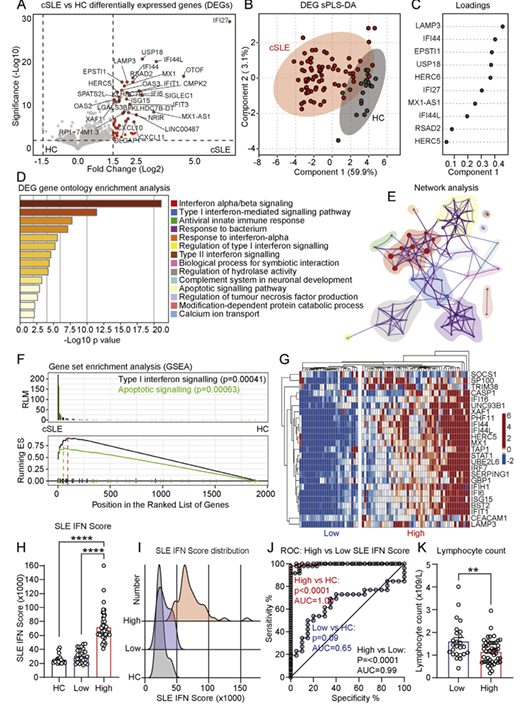
6. (ANN RHEUM DIS,IF:20.3) I型干扰素内型驱动儿童期发病SLE的不同临床轨迹,通过一种新颖的系统免疫学方法揭示
2025年12月18日,Ann Rheum Dis在线发表伦敦大学团队针对74例青少年系统性红斑狼疮(cSLE)的多组学图谱,整合Olink靶向血清蛋白质组、单分子阵列检测IFNα、RNA-seq及质谱流式,首次将患儿划分为IFN-high与IFN-low两大群体并细化为6个IFN驱动的免疫内型。
血清LAMP3以AUC=0.95精准标记IFN-high状态,ELISA验证其浓度在IFN-high组升高4.9倍且随58个月随访持续稳定,与LAG-3、IL-10同为anifrolumab治疗下调的共有关键蛋白,可直接指导抗IFN-Ⅰ治疗选择;结合BST2流式蛋白谱发现T细胞与浆细胞样树突细胞对IFN-Ⅰ最敏感,其蛋白表达水平可预测长期器官损伤风险。
该研究将高维蛋白质组数据与临床轨迹关联,IFN-high内型肾、脑、皮肤损伤累积更快且激素用量更高,而IFN-low内型预后最佳,提出以LAMP3为核心、蛋白质组驱动的cSLE精准分层框架,为青少年患者个体化用药和临床试验筛选提供可扩展的生物标志物工具。

7. (NUCLEIC ACIDS RES,IF:16.5) 原代人类细胞类型的转录组和蛋白质组图谱
2025年12月17日,美国梅奥诊所团队在Nucleic Acids Research发表最新研究,利用高分辨质谱技术绘制了28种人类原代细胞的转录组与蛋白质组综合图谱,为精准医学提供了重要的细胞类型特异性分子参考。
研究团队采用无标记定量蛋白质组学策略,从504次质谱运行中鉴定出10,480种蛋白质,覆盖上皮、内皮、间充质等七大细胞谱系。主成分分析显示,细胞类型的蛋白质表达模式与其组织来源无关,而与细胞谱系高度相关——这提示传统组织水平研究可能掩盖了细胞异质性。
该研究的蛋白质组学亮点在于:首次系统鉴定了39种翻译后修饰(PTM),包括丝氨酸O-乙酰化、组氨酸甲基化等罕见修饰,并发现色氨酸双氧化修饰富集于线粒体呼吸链复合物,提示其可能参与氧化磷酸化调控。团队还结合转录组数据,通过蛋白质基因组学策略验证了10个"缺失蛋白"(缺乏蛋白质水平证据的基因),并首次在肽段水平证实LDHB和MDH1的翻译通读事件。
此外,研究鉴定出上皮细胞特异性标志物C1orf116,经免疫组化验证其在乳腺、肝脏、肾脏等12种组织的上皮细胞中特异性表达,有望成为EpCAM的替代标志物。
该图谱为理解细胞类型特异性分子机制、发现疾病生物标志物及药物靶点提供了开放获取的高质量资源。
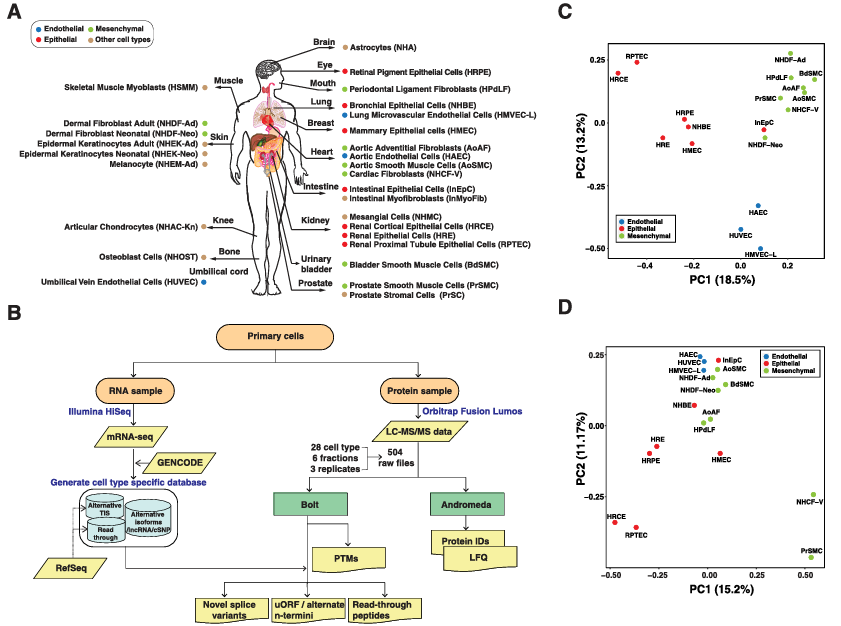
图. 原代细胞转录组和蛋白质组分析流程

8. (CIRC RES,IF:16.5) Apilimod通过抑制1-磷酸磷脂酰肌醇3-磷酸5-激酶促进血管平滑肌细胞的脂肪细胞样表型并防止动脉钙化
2025年12月17日在线发表于Circulation Research的这项研究,由德国亚琛工业大学团队完成,运用蛋白质组学、转录组学和激酶组学的整合策略,阐明了靶向PIKFYVE(1-磷脂酰肌醇-3-磷酸5-激酶)防治动脉钙化的分子机制。
研究团队首先通过液相色谱-质谱联用技术对人冠状动脉平滑肌细胞(SMC)进行深度表型分析。定量蛋白质组学数据显示,PIKFYVE抑制剂阿匹莫德(apilimod)可阻断SMC向成骨样表型转化,显著下调组织非特异性碱性磷酸酶(TNAP)的蛋白表达及酶活性,并减少I型前胶原分泌。进一步对SMC来源的细胞外囊泡(EV)进行蛋白质组学分析发现,药物干预使EV的矿化载荷(如TNAP cargo)显著降低,聚集能力减弱,从而抑制微钙化形成。
多组学整合分析揭示,阿匹莫德通过抑制YAP-TEAD信号轴,驱动SMC向脂肪细胞样表型转化——脂肪酸代谢通路基因上调、脂滴积累增加。体内实验证实,阿匹莫德可减少Ldlr缺陷小鼠的血管钙化和斑块TNAP活性,但伴随脂质沉积增加。
该研究通过多维度组学联用,首次在蛋白质水平阐明PIKFYVE通过调控EV cargo和SMC可塑性影响钙化进程,为开发抗钙化疗法提供了新靶点,同时警示需关注治疗相关的脂质代谢副作用。
原文链接: https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.125.326772
文献目录
01 (CANCER CELL) 多组学整合揭示致命第三亚型髓母细胞瘤中脂质依赖性的肿瘤异质性
02 (EUR HEART J) 蒽环类药物心脏毒性的机制:由心脏压力超负荷引起的代谢脆弱性的作用
03 (NAT REV ENDOCRINOL) 基于血液的肥胖生物标志物及其与疾病风险的相关性
04 (CELL METAB) 人类MASLD是一种昼夜性疾病,由多系统胰岛素抵抗和夜间胰岛素可用性降低驱动
05 (GUT) LY6D标识持续存在的干细胞样细胞,推动胰腺肿瘤发生
06 (ANN RHEUM DIS) I型干扰素内型驱动儿童期发病SLE的不同临床轨迹,通过一种新颖的系统免疫学方法揭示
07 (NUCLEIC ACIDS RES) 原代人类细胞类型的转录组和蛋白质组图谱
08 (CIRC RES) Apilimod通过抑制1-磷酸磷脂酰肌醇3-磷酸5-激酶促进血管平滑肌细胞的脂肪细胞样表型并防止动脉钙化
一起来看看本期的蛋白质组学精选优质文献吧!

1. (CANCER CELL,IF:48.8) 多组学整合揭示致命第三亚型髓母细胞瘤中脂质依赖性的肿瘤异质性
髓母细胞瘤是儿童最常见的恶性脑肿瘤,其中致死率极高的第3亚型(Group 3)研究迎来重要突破。2026年1月15日,Cancer Cell在线发表了一项大型多组学研究,团队整合分析了384例原发肿瘤样本的甲基化、转录组、蛋白质组、磷酸化蛋白质组及代谢组数据,系统揭示了肿瘤异质性背后的脂质代谢依赖机制。
通过蛋白质组学和磷酸化蛋白质组学分析,研究首次在蛋白水平证实MYC-FASN-SCD信号轴驱动脂质从头合成。然而,单纯抑制该通路会触发肿瘤细胞的代偿性逃逸——转而通过摄取外源性脂肪酸维持生存。
更关键的发现来自对脂滴-线粒体互作的蛋白质组学解析:MYC高表达不仅促进脂质合成,还诱导脂滴异常蓄积。肿瘤细胞形成独特的代谢依赖——必须依赖脂滴与线粒体之间的通讯来供能,这一机制在蛋白水平得到了精确验证。
该研究利用多组学整合策略,在蛋白质组层面锁定MYC下游的"脂质成瘾"弱点,为目前无有效治疗方案的Group 3髓母细胞瘤提供了精准干预新思路。研究证实靶向脂滴-线粒体互作可打破肿瘤代谢平衡,展现出良好的治疗开发前景。


2. (EUR HEART J,IF:37.6) 蒽环类药物心脏毒性的机制:由心脏压力超负荷引起的代谢脆弱性的作用
高血压和心脏瓣膜病增加蒽环类化疗药物心脏毒性的风险,但其分子机制长期不明。2025年12月,European Heart Journal发表了一项大型动物模型研究,通过蛋白质组学手段,首次系统阐明了左心室压力负荷如何通过代谢失衡诱发化疗心脏损伤。
研究采用尤卡坦小型猪模型,对四组动物(健康对照、单纯化疗、单纯主动脉缩窄、缩窄+化疗)进行长达8个月的纵向追踪。通过蛋白质组学分析,团队发现左心室压力负荷单独即可诱导三羧酸循环、钙信号及肌动蛋白细胞骨架调控相关蛋白簇显著上调,反映心肌处于高能量需求状态。此时心肌通过消耗磷酸肌酸储备维持ATP稳定,功能虽得以代偿,但形成"隐匿性代谢脆弱性"。
单纯低剂量化疗(多柔比星)虽未损害心功能,但蛋白质组学显示其已下调氧化磷酸化蛋白、上调糖酵解酶,提示代谢底物从脂肪酸向葡萄糖转换。当压力负荷与化疗双重打击时,蛋白质组学网络分析揭示线粒体呼吸链复合物I-V全面下调、糖酵解酶亦受抑制,心肌丧失能量供应能力,同时伴随细胞外基质重构和钙信号通路紊乱,最终导致心功能衰竭。
研究证实能量供需失衡是核心致病机制。体外实验中,使用肌球蛋白抑制剂mavacamten降低心肌能量需求,可显著挽救双重应激下的细胞存活率。这为高血压等压力负荷患者接受蒽环类化疗时的的心脏保护提供了可干预靶点,提示通过蛋白质组学指导的代谢调节策略具有重要临床价值。

https://academic.oup.com/eurheartj/advance-article/doi/10.1093/eurheartj/ehaf1060/8424139?login=true

3. (NAT REV ENDOCRINOL,IF:31.0) 基于血液的肥胖生物标志物及其与疾病风险的相关性
肥胖是2型糖尿病、心血管疾病和多种癌症的重要危险因素,但其分子机制尚未完全阐明。2026年,Nature Reviews Endocrinology发表综述,系统梳理了血液肥胖生物标志物的研究进展,特别强调了蛋白质组学技术在发现新型标志物中的关键作用。
传统肥胖标志物如瘦素、脂肪酸结合蛋白4(FABP4)和白介素-6(IL-6)主要通过动物实验发现。近十年来,高通量蛋白质组学技术推动了人类观察性研究中的标志物发现。大规模队列研究(样本量>1,000)采用SomaScan和Olink等靶向蛋白质组学平台,不仅重新确认了瘦素、FABP4、IL-6等经典标志物与肥胖的因果关联,还发现了补体因子I(CFAI)、晚期糖基化终产物受体(RAGE)和Wnt-β-catenin通路负调控因子AXIN1等新型肥胖相关蛋白。
特别值得注意的是,一项纳入30,931人的蛋白质组学孟德尔随机化研究发现,肥胖遗传风险与32种血浆蛋白水平存在因果关联,其中RAGE水平受肥胖负向调控,并与2型糖尿病风险呈负相关、与前列腺癌风险呈正相关。另一项研究利用Olink高灵敏度免疫分析平台鉴定出21个蛋白组成的"肥胖相关炎症特征",可预测全因死亡、心脏死亡及主要心血管不良事件。
蛋白质组学研究揭示了肥胖与代谢疾病的蛋白网络关联,但不同平台间标准化不足、批次效应等问题仍待解决。未来需在大规模前瞻性队列中验证新型标志物的疾病预测价值,并探索其作为干预靶点的潜力。


4. (CELL METAB,IF:27.7) 人类MASLD是一种昼夜性疾病,由多系统胰岛素抵抗和夜间胰岛素可用性降低驱动
代谢功能障碍相关脂肪性肝病(MASLD)影响全球约40%人口,但其昼夜代谢特征长期不明。2026年3月3日,Cell Metabolism发表了一项临床研究,通过蛋白质组学手段,首次揭示MASLD是一种"夜间疾病"——患者在夜间表现出多系统胰岛素抵抗和代谢功能障碍。
研究团队对12例MASLD患者和12例对照进行昼夜代谢表型分析,采用Olink靶向蛋白质组学检测血浆中691种心血管代谢和炎症相关蛋白,并结合液相色谱-串联质谱(LC-MS/MS)对脂肪组织和骨骼肌进行非靶向蛋白质组学分析。
血浆蛋白质组学发现,MASLD患者夜间生长分化因子15(GDF-15)显著上调,而组织型纤溶酶原激活物(tPA)及其抑制剂PAI-1显著下调。GDF-15作为营养应激标志物,与β-氧化标志物3-羟基丁酸呈强正相关,提示其可能通过促进脂肪酸氧化发挥代偿保护作用。UK Biobank大样本验证(54,219人)证实了这些蛋白的昼夜节律模式,且MASLD患者GDF-15昼夜差异更为显著。
组织蛋白质组学进一步揭示:脂肪组织中二甲基精氨酸二甲胺水解酶1(DDAH1)夜间升高并与脂解标志物正相关;骨骼肌中蛋白质-异戊二烯半胱氨酸O-甲基转移酶(ICMT)夜间下调,该蛋白与葡萄糖处置率、胰岛素敏感性及丙酮酸氧化呈正相关,提示其可能通过调控Rac1信号影响外周葡萄糖摄取。
值得注意的是,即使经过12周减重干预、肝脏脂肪含量显著降低后,这些夜间代谢功能障碍仍持续存在,表明夜间代谢紊乱可能是MASLD的原发驱动因素而非继发现象。该研究为MASLD的时辰治疗策略——包括优化能量摄入时间、运动时段和药物递送窗口——提供了分子靶点和理论依据。


5. (Gut,IF:23.0) LY6D标识持续存在的干细胞样细胞,推动胰腺肿瘤发生
胰腺导管腺癌(PDAC)是恶性程度极高的肿瘤,其早期细胞异质性是驱动肿瘤进展的关键。2026年1月16日,Gut在线发表研究,通过单细胞RNA测序和TurboID邻近蛋白质组学技术,鉴定出LY6D作为PDAC早期促癌细胞状态的标志物。
研究团队首先整合公共及自有的单细胞测序数据,识别出LY6D+胃样细胞亚群在早期异质性中出现并持续存在于肿瘤发生全程。为阐明其分子机制,研究采用TurboID邻近蛋白质组学技术——利用抗坏血酸过氧化物酶(APEX2)标记LY6D蛋白的邻近互作网络。这一蛋白质组学方法成功捕获了LY6D作为糖基磷脂酰肌醇(GPI)锚定蛋白,在脂筏区域支架化激酶信号网络的功能。
该蛋白质组学分析揭示了LY6D通过脂筏相关激酶网络驱动FOSL1依赖的表观遗传-转录重编程,赋予细胞干性特征和独特的氧化磷酸化(OXPHOS)代谢依赖。遗传学实验证实,Ly6d敲除特异性损害胃样谱系并延迟肿瘤发生,而过表达则增强致瘤和转移潜能。
在人类PDAC队列中,LY6D+细胞富集干性和上皮-间质转化(EMT)特征,高LY6D表达是预后不良的独立标志物。该研究将蛋白质组学发现的LY6D+细胞状态定义为连接早期癌前异质性与PDAC发生进展的关键驱动因素,为PDAC的早期检测和全阶段治疗干预提供了新靶点和候选生物标志物。
原文链接: https://pubmed.ncbi.nlm.nih.gov/41545197/

6. (ANN RHEUM DIS,IF:20.3) I型干扰素内型驱动儿童期发病SLE的不同临床轨迹,通过一种新颖的系统免疫学方法揭示
2025年12月18日,Ann Rheum Dis在线发表伦敦大学团队针对74例青少年系统性红斑狼疮(cSLE)的多组学图谱,整合Olink靶向血清蛋白质组、单分子阵列检测IFNα、RNA-seq及质谱流式,首次将患儿划分为IFN-high与IFN-low两大群体并细化为6个IFN驱动的免疫内型。
血清LAMP3以AUC=0.95精准标记IFN-high状态,ELISA验证其浓度在IFN-high组升高4.9倍且随58个月随访持续稳定,与LAG-3、IL-10同为anifrolumab治疗下调的共有关键蛋白,可直接指导抗IFN-Ⅰ治疗选择;结合BST2流式蛋白谱发现T细胞与浆细胞样树突细胞对IFN-Ⅰ最敏感,其蛋白表达水平可预测长期器官损伤风险。
该研究将高维蛋白质组数据与临床轨迹关联,IFN-high内型肾、脑、皮肤损伤累积更快且激素用量更高,而IFN-low内型预后最佳,提出以LAMP3为核心、蛋白质组驱动的cSLE精准分层框架,为青少年患者个体化用药和临床试验筛选提供可扩展的生物标志物工具。


7. (NUCLEIC ACIDS RES,IF:16.5) 原代人类细胞类型的转录组和蛋白质组图谱
2025年12月17日,美国梅奥诊所团队在Nucleic Acids Research发表最新研究,利用高分辨质谱技术绘制了28种人类原代细胞的转录组与蛋白质组综合图谱,为精准医学提供了重要的细胞类型特异性分子参考。
研究团队采用无标记定量蛋白质组学策略,从504次质谱运行中鉴定出10,480种蛋白质,覆盖上皮、内皮、间充质等七大细胞谱系。主成分分析显示,细胞类型的蛋白质表达模式与其组织来源无关,而与细胞谱系高度相关——这提示传统组织水平研究可能掩盖了细胞异质性。
该研究的蛋白质组学亮点在于:首次系统鉴定了39种翻译后修饰(PTM),包括丝氨酸O-乙酰化、组氨酸甲基化等罕见修饰,并发现色氨酸双氧化修饰富集于线粒体呼吸链复合物,提示其可能参与氧化磷酸化调控。团队还结合转录组数据,通过蛋白质基因组学策略验证了10个"缺失蛋白"(缺乏蛋白质水平证据的基因),并首次在肽段水平证实LDHB和MDH1的翻译通读事件。
此外,研究鉴定出上皮细胞特异性标志物C1orf116,经免疫组化验证其在乳腺、肝脏、肾脏等12种组织的上皮细胞中特异性表达,有望成为EpCAM的替代标志物。
该图谱为理解细胞类型特异性分子机制、发现疾病生物标志物及药物靶点提供了开放获取的高质量资源。

图. 原代细胞转录组和蛋白质组分析流程

8. (CIRC RES,IF:16.5) Apilimod通过抑制1-磷酸磷脂酰肌醇3-磷酸5-激酶促进血管平滑肌细胞的脂肪细胞样表型并防止动脉钙化
2025年12月17日在线发表于Circulation Research的这项研究,由德国亚琛工业大学团队完成,运用蛋白质组学、转录组学和激酶组学的整合策略,阐明了靶向PIKFYVE(1-磷脂酰肌醇-3-磷酸5-激酶)防治动脉钙化的分子机制。
研究团队首先通过液相色谱-质谱联用技术对人冠状动脉平滑肌细胞(SMC)进行深度表型分析。定量蛋白质组学数据显示,PIKFYVE抑制剂阿匹莫德(apilimod)可阻断SMC向成骨样表型转化,显著下调组织非特异性碱性磷酸酶(TNAP)的蛋白表达及酶活性,并减少I型前胶原分泌。进一步对SMC来源的细胞外囊泡(EV)进行蛋白质组学分析发现,药物干预使EV的矿化载荷(如TNAP cargo)显著降低,聚集能力减弱,从而抑制微钙化形成。
多组学整合分析揭示,阿匹莫德通过抑制YAP-TEAD信号轴,驱动SMC向脂肪细胞样表型转化——脂肪酸代谢通路基因上调、脂滴积累增加。体内实验证实,阿匹莫德可减少Ldlr缺陷小鼠的血管钙化和斑块TNAP活性,但伴随脂质沉积增加。
该研究通过多维度组学联用,首次在蛋白质水平阐明PIKFYVE通过调控EV cargo和SMC可塑性影响钙化进程,为开发抗钙化疗法提供了新靶点,同时警示需关注治疗相关的脂质代谢副作用。
原文链接: https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.125.326772







