
2023年11月6日,西湖大学蛋白质组大数据实验室郭天南团队与苏州大学徐璎课题组在 Molecular & Cellular Proteomics 上合作发表了新的文章 Multi-tissue circadian proteome atlas of wild-type and Per1-/-/Per2-/- mice。西湖欧米负责该研究的数据分析工作。
文章主要报道了来自野生型(WT)和生物钟缺陷 Per1/Per2 双基因敲除(DKO)小鼠的昼夜节律性蛋白质组图谱。这些蛋白质组学资源(https://prot-rhythm.prottalks.com/)从时空维度上,协助探索昼夜节律产生的分子基础和PER1/2调节的分子机制。
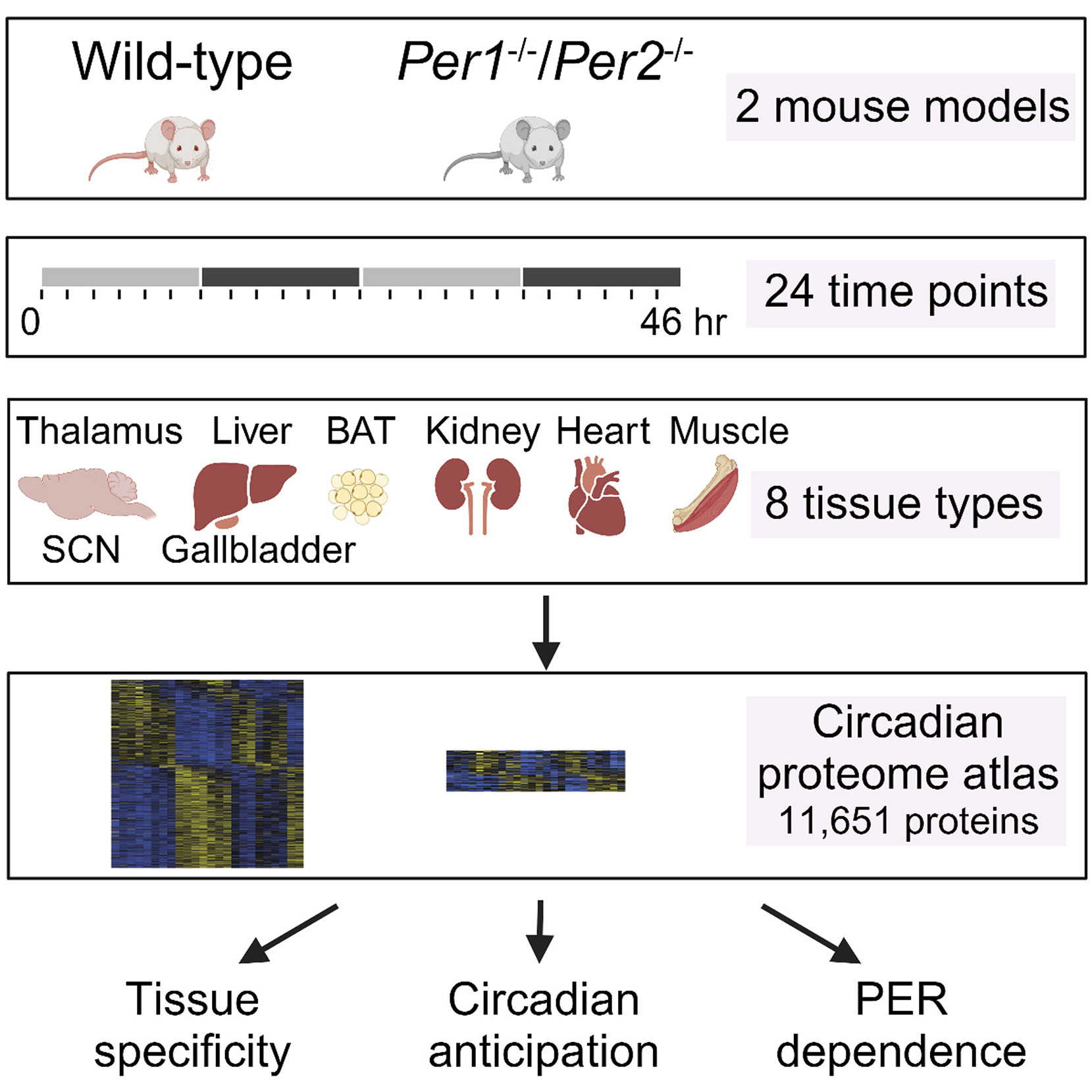
与传统的基于转录水平的生物节律研究相比,这篇文章从蛋白质组水平对小鼠的节律性蛋白质组进行了多器官研究。本研究将WT和 Per1/Per2 DKO 两组小鼠在12小时光照和12小时黑暗的光照环境下适应至少1周后将其释放到持续暗期中并进行2小时时间间隔、持续48小时的时序性样本采集采集样本包括8种不同类型组织的样本(丘脑、SCN区域、肝脏、带胆汁的胆囊、棕色脂肪组织、肾脏、心脏和腓肠肌),使用TMT标记的蛋白质组分析,共鉴定了超过11,000个蛋白质。
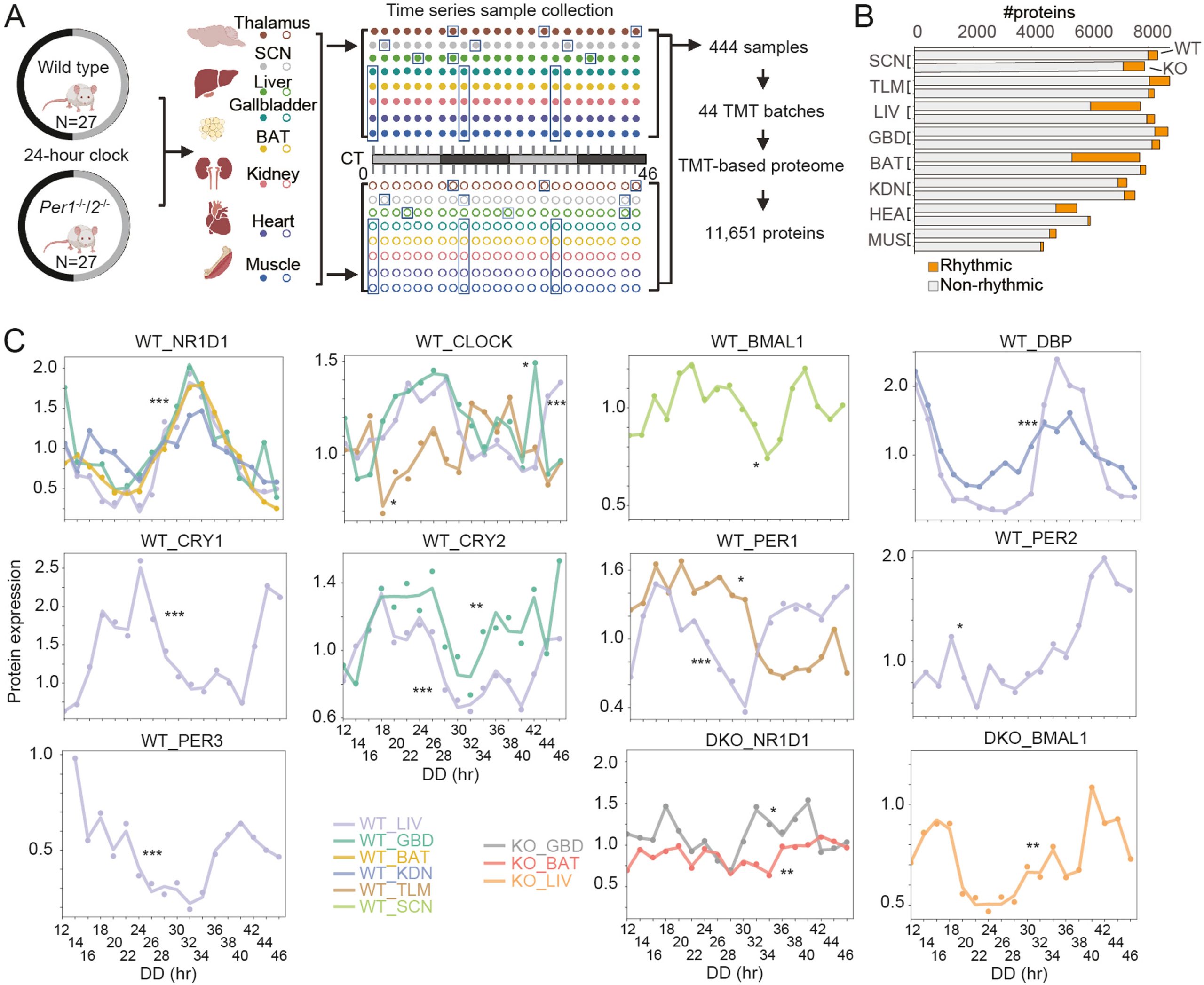
WT和DKO小鼠的蛋白质组学工作流程和多组织昼夜节律景观概述
通过 MetaCycle 分析各器官的节律性蛋白质,研究人员发现:
1)DKO小鼠核心时钟蛋白的节律性几乎被消除;
2)TTFL控制大部分节律性蛋白的表达。
通过比较蛋白和RNA水平的节律基因相位,发现在WT小鼠所有器官中,节律性mRNA和蛋白质相位分布差异显著。其中,WT小鼠中节律性蛋白的峰值阶段主要聚集在两个狭窄的光暗转换窗口内,而节律性mRNA相位分布相对均匀,表明在WT小鼠中,蛋白水平的节律性对节律性活动-休息期的预期更强。在DKO小鼠中,蛋白节律性表达在不同组织的峰相呈分散分布,表明PER1/2可能控制了生物节律的预期。
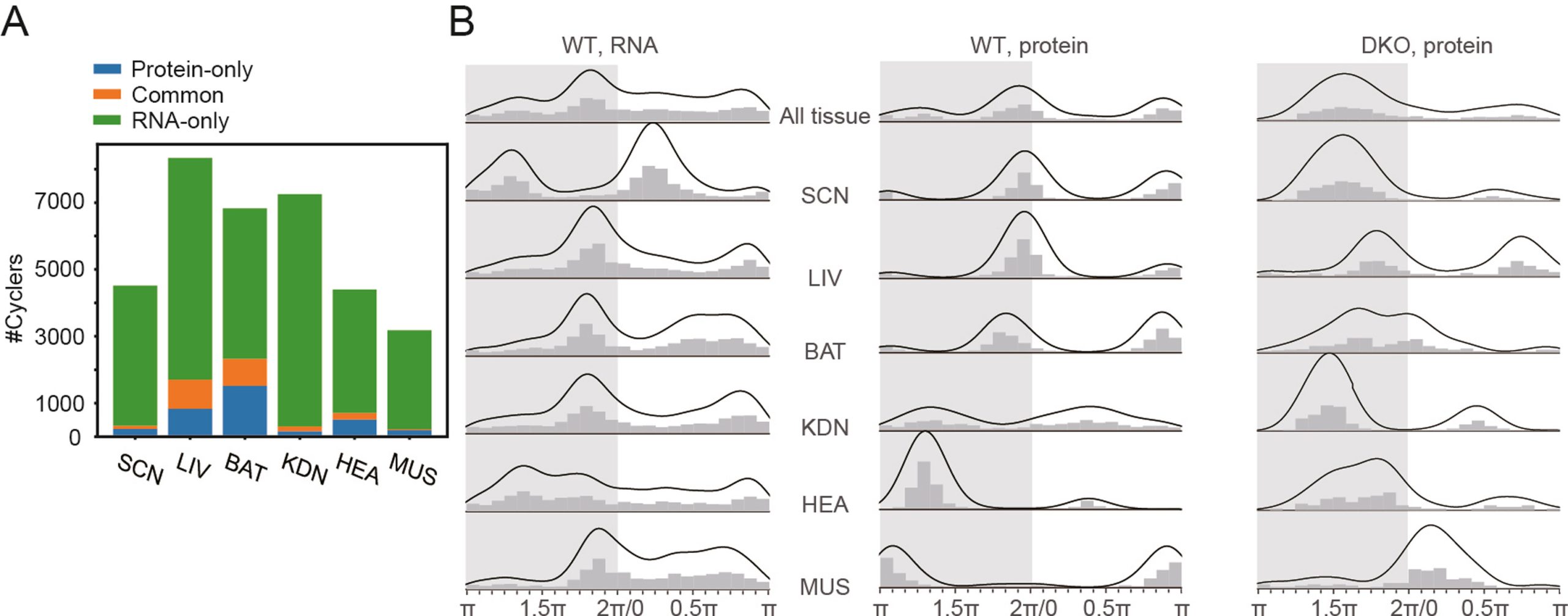
WT 小鼠多个组织中节律性 mRNA 和蛋白质的比较
随后研究人员研究了多器官节律性,发现47.7%的节律蛋白质是组织特异性的,这一比例明显高于节律mRNA所显示的19.9%。通过相集富集分析(PSEA)进一步研究WT小鼠中节律蛋白质和mRNA的功能和相位,发现时间上同步化富集的通路在蛋白水平表现出更高的组织特异性,而且即使是不同组织间共同富集的通路,更高比例的富集的通路在蛋白水平表现出相位的几乎倒置(即相位相差10小时以上),进一步从功能上体现了节律性蛋白的组织特异性。
通过比较WT和DKO小鼠间的节律蛋白组,发现WT小鼠中的组织特异性蛋白主要依赖于PERs。为了进一步研究PER依赖通路,研究人员使用IPA对WT和DKO小鼠中的所有节律蛋白进行了通路富集分析,发现与核苷酸切除修复(NER)、增殖、细胞骨架组织和代谢相关的通路在WT小鼠中特异性富集。这表明PER1/2在生物钟调控中发挥着重要作用,尤其是在DNA修复通路方面。
NER通路是受生物钟严密调控的DNA修复机制之一。在NER通路失活的情况下,DNA损伤引起的突变和染色体畸变的风险增加,这可能导致癌症发生的风险增加。因此,了解NER通路的生物钟调控机制对于时间化疗的指导具有重要意义。在实践中,可能可以根据NER通路中蛋白的节律性表达来确定化疗的最佳时间,以提高疗效并减少副作用。
最后,研究者基于时间序列的蛋白质组数据进行了Spearman等级相关性分析来探究不同组织间节律性的同步性,在WT和DKO小鼠中分别鉴定到了739和33个具有显著时间相关性的节律蛋白。
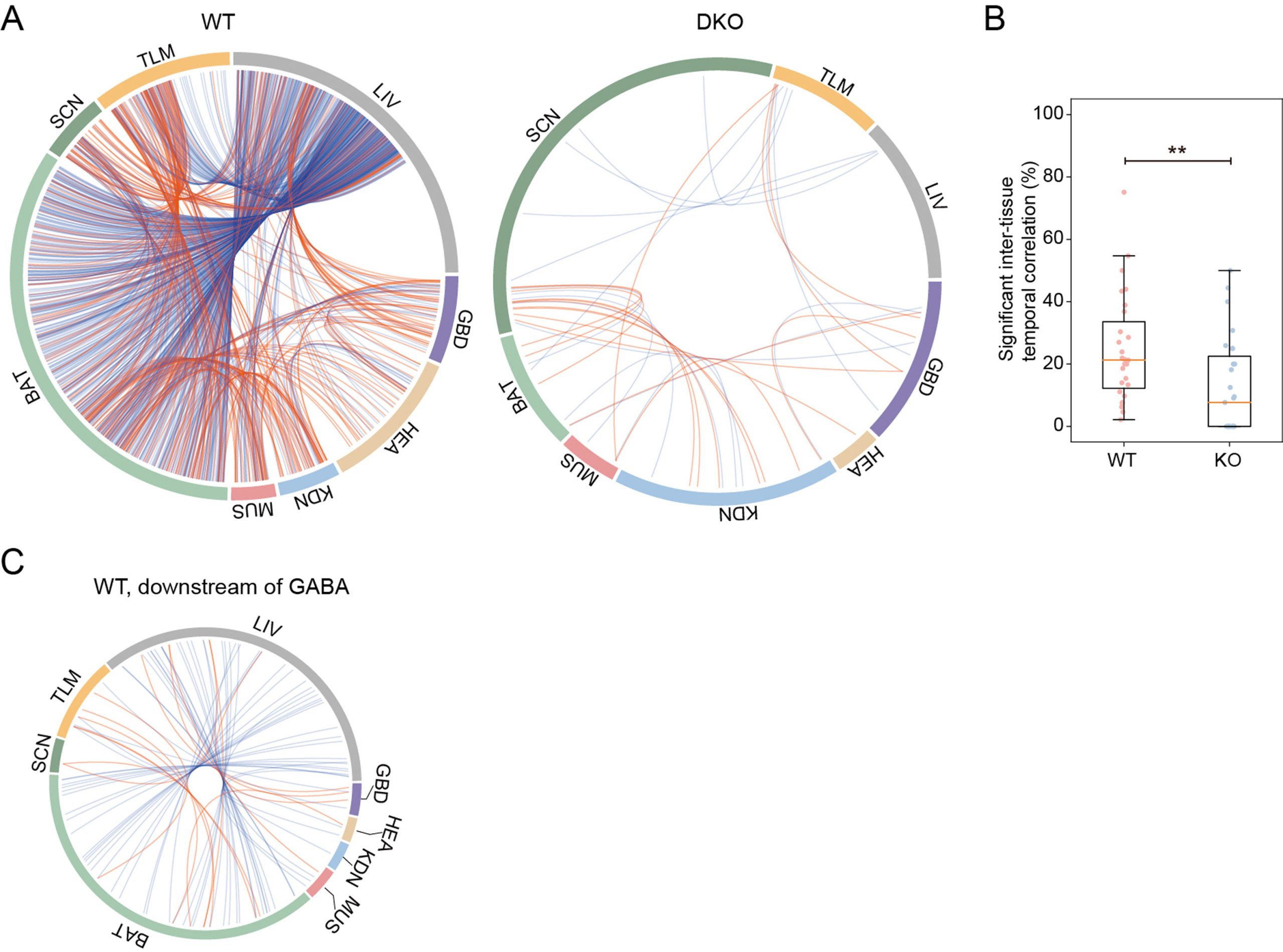
昼夜节律蛋白组的组织间相关性
与DKO小鼠(12.5%)相比,WT小鼠各组织中具有时序相关性的节律蛋白比例(24.7%)明显更高,表明在Per1和Per2缺失的情况下,昼夜蛋白组存在严重的组织间时序变化失调。随后通过IPA上游调节因子分析了这些同步化的节律蛋白的潜在同步化因子,发现γ-氨基丁酸(GABA)是最显著富集的上游调节因子,它被注释为调节50个时序相关的节律蛋白。GABA已被报道参与了生物钟神经元的同步和SCN内区域起搏器的耦合。在我们的数据中,它可能在昼夜蛋白组的组织间相关性中发挥作用,这需要进一步验证。
综上,这项研究通过对多个器官和组织的蛋白质节律性表达进行全面分析,揭示了不同组织之间生物钟活动的复杂性和特异性。这些组织特异性的生物钟蛋白质表达主要依赖于PER蛋白,并直接参与了它们来源组织的主要生物学功能。这对于理解生物钟在健康和疾病状态下的作用,以及在临床治疗中的应用具有重要意义。研究者还开发了网站(https://prot-rhythm.prottalks.com)方便读者访问所有数据集和统计分析。
本研究也存在一些局限性。例如,尽管研究者在获取视交叉上核(SCN)含量区域时采取了经验丰富的操作,使用免疫荧光和RT-PCR分析确认了SCN的纯度,但仍无法排除来自SCN周围组织的污染可能性。这可能会影响到蛋白质组数据的准确性。其次,尽管本研究的蛋白质组学分析深度高于文献中的其他研究,但仍然存在一些已知的核心生物钟蛋白质未能在每个样本中鉴定的情况,未来需要进行更深入的蛋白质组学研究。
论文链接:
https://www.mcponline.org/article/S1535-9476(23)00186-X/fulltext






