5月21日,西湖大学医学院郭天南团队,联合中国18个临床中心,在 Chinese Medical Journal 发表了一篇基于蛋白质组学系统分析甲状腺滤泡癌的研究论文,筛选出了可区分良恶性滤泡肿瘤的关键蛋白,并揭示了IGF2R、MVP、HDAC1和H1-5在肿瘤进展中的潜在作用。
西湖欧米负责该研究的部分质控及数据分析工作。

图1 文章截图
提纲挈领
研究通过多中心大样本队列,结合平行反应监测质谱(PRM-MS)和机器学习技术,筛选并验证了30个可用于区分甲状腺滤泡癌(FTC)与甲状腺滤泡腺瘤(FTA)的关键蛋白,重点揭示了IGF2R、MVP、HDAC1和H1-5在FTC中的高表达及其在肿瘤细胞增殖中的促进作用,明确了它们的分子互作关系,并通过细胞实验和临床组织免疫组化进一步验证其功能和临床潜力,为FTC的精准诊断和靶向治疗提供了新的分子依据。
甲状腺滤泡癌(follicular thyroid carcinoma, FTC)是甲状腺癌中第二常见的一种亚型,其在临床上常与良性的滤泡性甲状腺腺瘤(follicular thyroid adenoma, FTA)表现出高度相似的细胞学形态,导致二者在术前诊断中难以准确区分。
依赖病理形态学的传统诊断方式局限性明显,且缺乏稳定的分子标志物,也制约了精准治疗策略的发展。因此,识别能够有效区分FTC与FTA的分子特征,对于提高诊断准确性和推动个体化治疗具有重要意义。
为此,本研究团队整合18家临床中心的资源,构建了包含1439例甲状腺石蜡组织样本的大规模多中心队列,采用靶向蛋白质组学(PRM-MS)技术对94个潜在蛋白标志物进行靶向定量检测,并结合多种机器学习算法进行特征筛选,系统筛定出30个在FTC与FTA中表达显著差异的核心蛋白。
随后,研究团队进一步围绕其中代表性的IGF2R、MVP、HDAC1和H1-5开展了一系列功能验证实验,旨在揭示这些蛋白在FTC发生发展过程中的作用及其相互调控机制。
01 FTC–FTA 鉴别相关候选蛋白的筛选与确认
基于团队前期蛋白质组学研究和公开数据库(如TCGA和OMIM),研究初步筛选出了149种与FTC相关的候选蛋白。建立并优化的PRM-MS检测流程成功鉴定到了其中94种在FTC与FTA间差异表达的蛋白,包括与甲状腺激素合成相关的TG、CTSB和TPO,以及与甲状腺癌相关的标志物CDH1、VIM和DPYSL3。
随后,基于PRM-MS检测流程,研究人员定量了来自18家中心共1085例患者的石蜡包埋组织样本的94个目标蛋白。
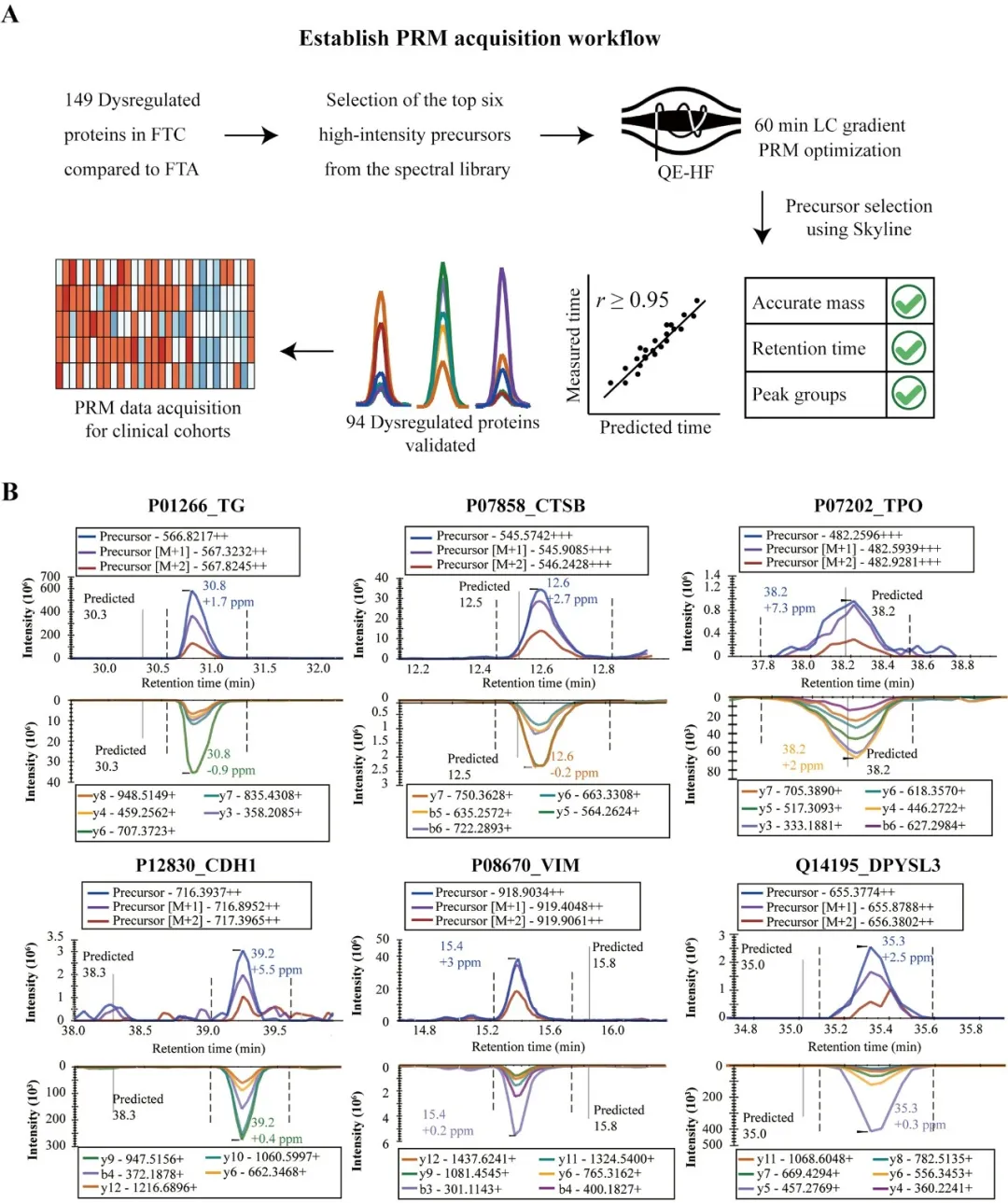
图2 PRM采集工作流程
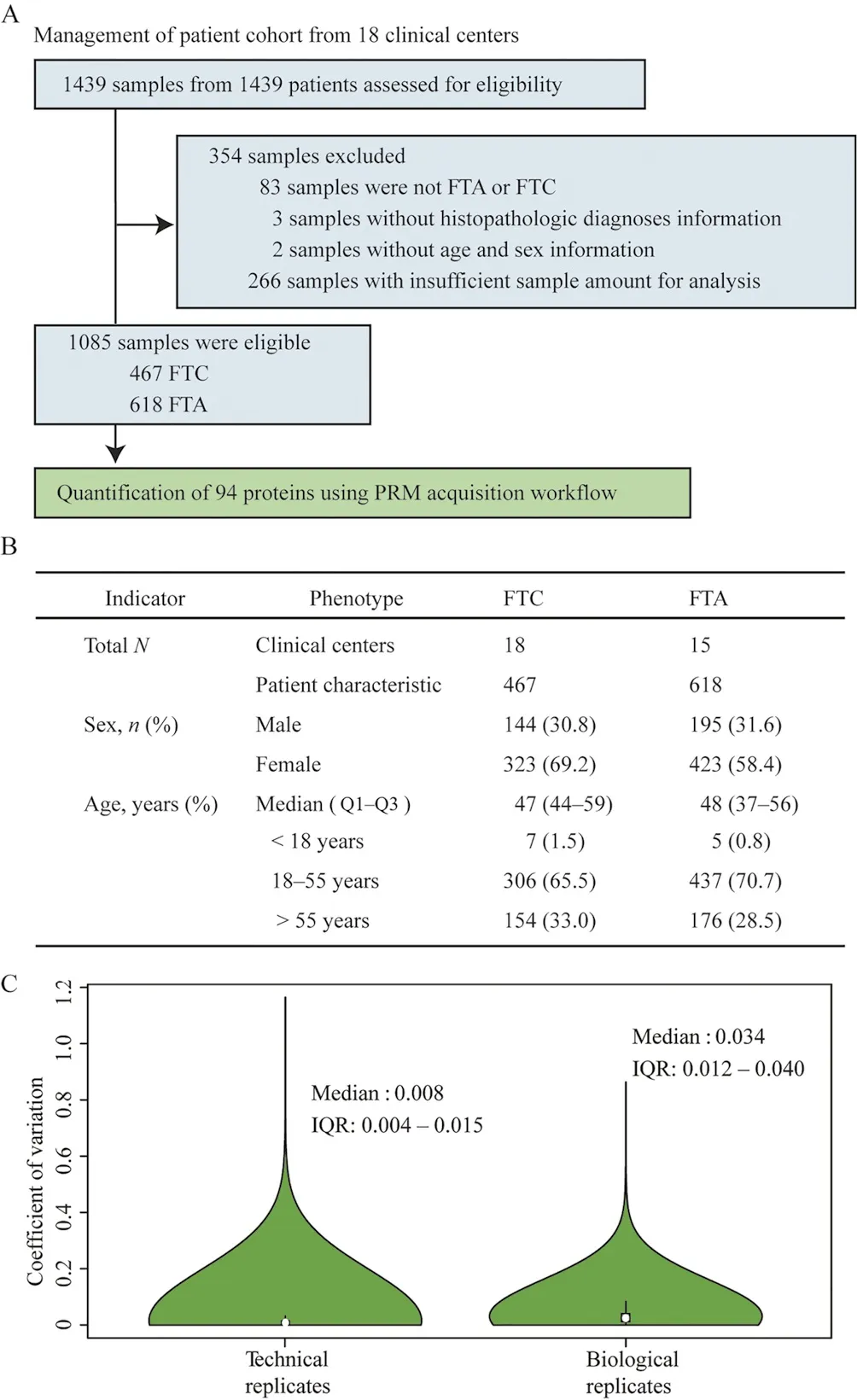
图3 临床样本的PRM数据采集
02 FTC蛋白表达矩阵及功能通路特征
通过建立的PRM检测流程,研究构建了包含94种蛋白和1085个样本的蛋白定量矩阵。质量控制中,生物和技术重复的变异系数的中位数分别为0.03和0.01,说明检测流程的稳定性和重复性良好。
进一步分析显示,FTC中上调的蛋白聚集于细胞迁移和染色质调控相关通路,而下调蛋白涉及代谢、炎症与适应性免疫反应,提示FTC在肿瘤进展中呈现免疫逃逸和代谢重编程趋势。
03 区分FTC–FTA核心蛋白的进一步筛选
基于上述蛋白定量矩阵,研究采用三种特征选择算法(RFE、RFE-SHAP、Boruta-SHAP)对差异蛋白进行进一步筛选,并通过XGBoost建模与交叉验证,最终确定30个最具区分能力的核心蛋白。
这些蛋白在机器学习模型中表现出较高的FTC-FTA区分能力(平均AUC为0.86),展现出良好的诊断潜力。其中已有文献支持的与甲状腺癌相关的蛋白包括TPO、DPYSL3、ACE、MATN2、DPP4等。
其中,已知与多种癌症(包括乳头状甲状腺癌、结肠癌、肺癌、肝癌和卵巢癌)预后相关的MVP,但尚未有报道与FTC直接相关,需要进一步的研究和验证。
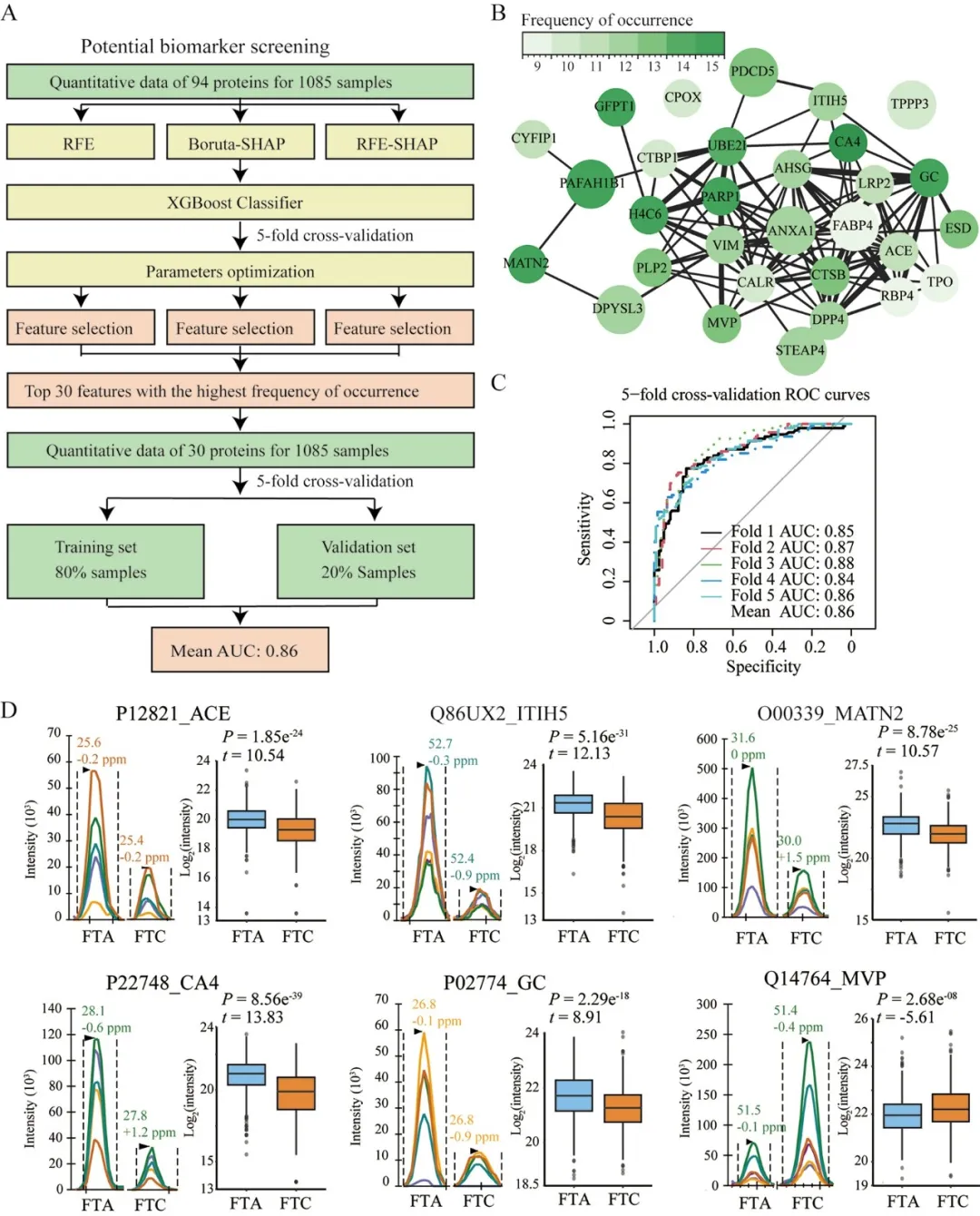
图4 基于机器学习模型的差异蛋白筛选
04 MVP、IGF2R、HDAC1和H1-5的潜在互作机制
研究发现MVP在FTC中表达上调,可能与IGF2R、HDAC1和H1-5相互作用,共同参与信号传导和染色质重塑,影响癌症进展。研究推测IGF2R可能通过MVP传递信号,而MVP与HDAC1协同调控H1-5相关的染色质结构,从而共同促进FTC的发生发展。
为了进一步验证以上推论,作者在FTC-133细胞系中进行了一系列实验。在FTC-133细胞系中,IGF2R、MVP、HDAC1和H1-5均呈现高表达。
Co-IP实验证实了IGF2R-MVP、MVP-HDAC1以及HDAC1-H1-5之间的直接相互作用,同时免疫荧光结果显示HDAC1与H1-5在细胞核内共定位,进一步验证了这一蛋白互作网络的生物学相关性。
05 四种关键蛋白在细胞功能中的作用验证
研究通过过表达和敲低实验,验证四种蛋白对FTC-133细胞增殖能力的影响。结果显示,MVP、HDAC1和H1-5的过表达均能显著增强克隆形成能力,而敲低IGF2R、MVP、HDAC1和H1-5的表达则显著抑制细胞增殖。
在临床层面,研究通过免疫组化对上述四种蛋白的表达进行了验证,结果显示IGF2R和MVP(主要定位于胞质/膜),HDAC1和H1-5(主要定位于胞核)在FTC组织中的表达显著高于FTA。
总 结
本研究通过靶向蛋白质组学结合机器学习,从18个临床中心1439例FTC/FTA样本中筛选出30个关键差异蛋白,揭示了蛋白质组学在解析FTC分子机制中的重要作用。细胞实验进一步验证IGF2R、MVP、HDAC1和H1-5作为疾病进展的核心调控因子,其相互作用网络为开发靶向治疗策略提供了新方向。
论文链接:
https://journals.lww.com/cmj/fulltext/9900/proteomic_analysis_reveals_modulation_of_key.1557.aspx