♦ 研究背景及简介
HIV-1治愈的一个主要障碍是病毒库的持久性,其主要指潜伏感染的细胞携带转录沉默、具有复制能力的病毒,这些病毒逃避抗逆转录病毒治疗(ART)以及免疫介导的清除。在未进行ART时,免疫系统通常无法遏制HIV-1复制。
然而,高达10%-20%的受试者在获得HIV-1后第一周内开始ART,在ART中断后可暂时实现HIV-1病毒血症抑制(ATI)。了解ATI后免疫介导的病毒血症控制背后的机制是朝着功能性HIV治愈迈进的关键。有间接证据表明,肠道微生物组也可能有助于免疫介导的HIV-1复制控制,但目前缺乏关于肠道微生物组组成在对治疗策略的反应中的作用以及与ART中断后病毒控制的关系的数据。
2022年,来自IrsiCaixa AIDS研究所等团队的研究者在Microbiome上发表了一篇名为“Gut microbiome signatures linked to HIV-1 reservoir size and viremia control”的文章,该研究针对BCN02临床试验(纳入15名在HIV传播后前6个月内开始ART治疗的具有持续病毒抑制的HIV-1感染者),提出了一项包含宏蛋白组在内的多组学分析,用以确定HIV-1控制感染与肠道微生物的相关性。
结果表明,MAP期间的病毒血症控制者组在疫苗接种前和整个研究干预期间表现出更高的拟杆菌/梭菌比值和较低的微生物基因丰富度。粪便宏蛋白组分析证实基线功能差异主要由梭菌驱动。拟杆菌/梭菌比值以及宿主免疫激活特征与HIV-1储库大小呈负相关。
因此,拟杆菌/梭菌比值是一种新型肠道微生物组特征,与 HIV-1 储库大小和 ART 中断后免疫介导的病毒控制相关。

图1 文章标题
♦ 研究样本
(1)研究样本:粪便、外周血单核细胞PBMC、血浆。其中,粪便样本纵向收集时间节点:pre-Vax:研究之初;MVA1: 第一次疫苗接种后1周;RMD: 罗米地辛每3周给药后一周;MVA2: 第2次疫苗接种后4周;MAP: ART中断后3-34周内;
(2)组学方法:宏基因组、宏蛋白组、转录组、Olink血浆蛋白组。
♦ 研究结果
◊ 微生物多样性和丰度与年龄相关
在本项微生物组子研究中,研究者评估了BCN02临床试验中的13名患者。其中,3名患者在32周MAP(viremic controllers)内持续出现低水平HIV血浆病毒血症(<2000拷贝/mL),9例在MAP(non-controllers)期间出现HIV-1 RNA反弹,另外一名受试者B07不符合MAP条件故被判定为non-controller组。
研究参与者平均年龄是42岁,平均体重为22.0kg/m2。中线基线CD4 T细胞技术为728细胞/mm3, 中位CD4/CD8 T细胞比例为1.4。所有受试者在HIV-1感染后的前3个月内,开始接受triple ART治疗>3年。HIV-1感染前DNA中位基线水平为140拷贝/10^6 CD4+ T细胞,在controller组中明显低于non-controller组(65 vs 165 拷贝/10^6 CD4+ T细胞)。
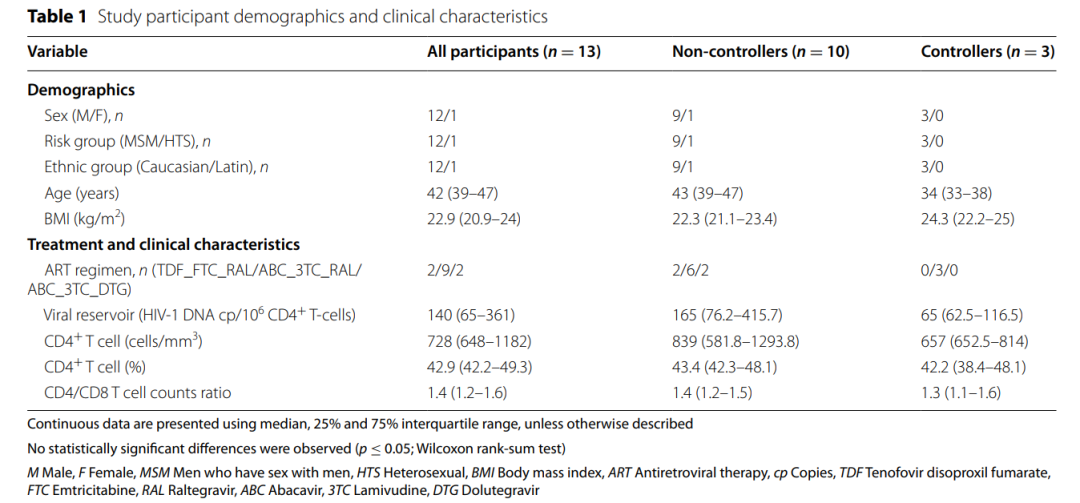
图2 受试者临床特征
◊ 基线肠道相关拟杆菌/梭菌比值和较低的微生物基因丰度区分病毒血症controller组和non-controller组
病毒血症controller组的拟杆菌/梭菌比值在研究之初和干预阶段一直较高。Controller组表现出较低的β多样性,并且显示出比non-controller组更少的宿主内纵向演变。
虽然两组的肠道微生物组成显著不同,但跨时间点上并没有观察到显著的纵向差异,这表明联合干预并没有显著改变肠道-微生物组成。此外,经代谢途径纵向分析表明,controller组主要富含与脂肪酸生物合成相关的功能,而与甲烷生成和碳水化合物生物合成相关的功能在non-controller组中过表达。
综上,在BCN02研究中开始干预之前,两组之间的差异主要来自常驻微生物群落。
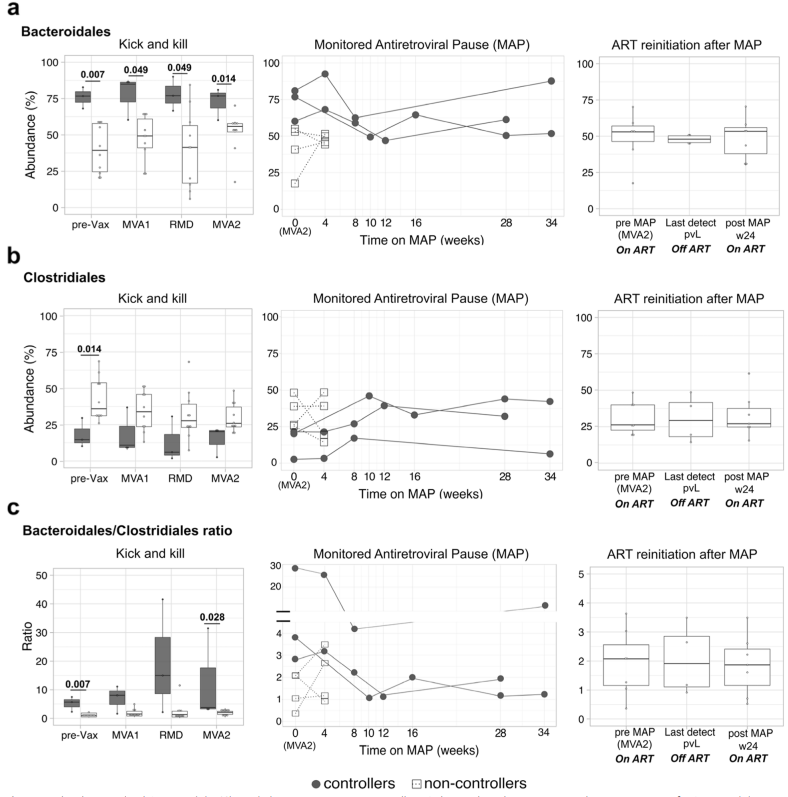
图3 病毒血症controller组中拟杆菌/梭菌比值较高
◊ 病毒血症controller组中拟杆菌/梭菌比值的增加与纵向HIV-1病毒库大小呈负相关
在研究开始之初和干预阶段,拟杆菌/梭菌比值与总CD4+ T细胞显著相关,但与基因丰度相反。
在两项评估中,α多样性与病毒库呈弱正相关,相关性不显著。拟杆菌/梭菌的基线比值与基因丰度成强负相关。
在纵向比较中,controller组倾向于显示较低的病毒库大小。
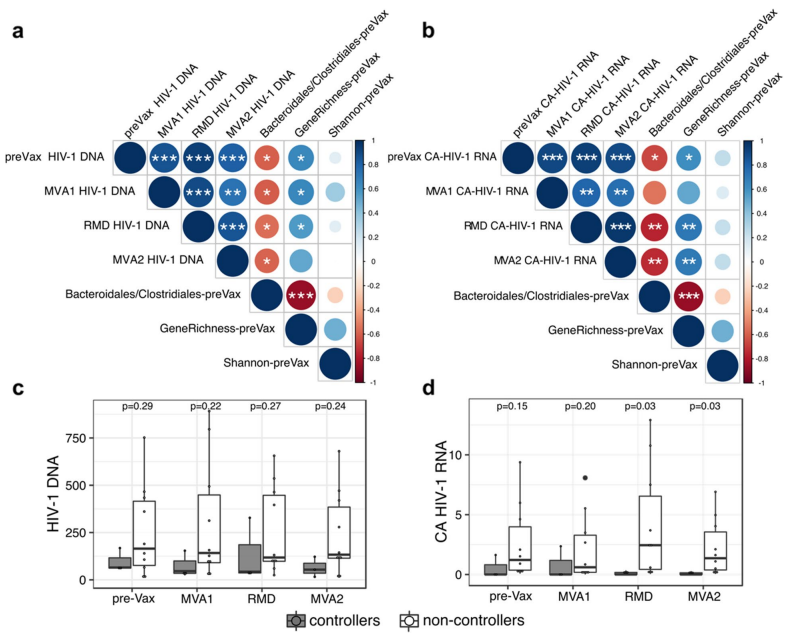
图4 HIV-1 储库大小与肠道微生物特征之间的关联
◊ 与病毒血症控制相关的不同细菌蛋白特征
使用基线蛋白质组数据(15214种微生物蛋白),跨样品对24个目和69个属进行定量,从宏蛋白质组数据中得出的总拟杆菌和总梭菌目在组间没有差异,但基于梭状芽胞杆菌属的无偏分层聚类显示组间蛋白质差异(p< 0.025)。
研究发现controller组富含来自蓝褐藻、瘤胃球菌的细菌蛋白。
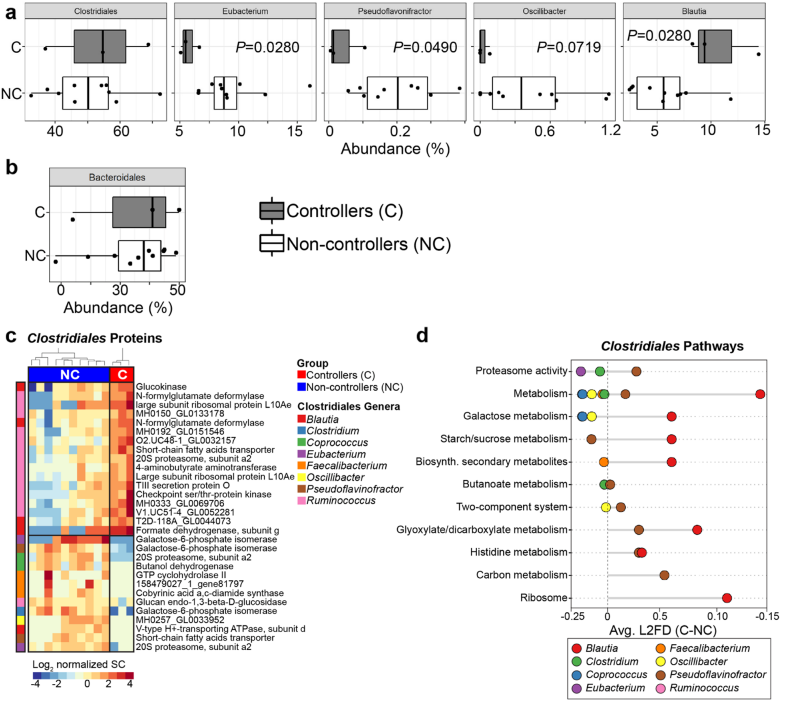
图5 与ART中断后HIV控制相关的基线宏蛋白组学特征
◊ 病毒血症controller组的基线免疫激活和炎症反应转录物增加
在过滤低表达基因后,全PBMC基因表达分析在基线上总共检测到27426个转录本,共鉴定出31个差异表达基因,其中15个和16个在controller组和non-controller组中上调。
GO分析表明,controller组中上调的基因富含与免疫系统激活相关的功能,例如中性粒细胞介导的免疫,白细胞脱颗粒和抗菌体液反应。
此外,一组验证相关的血浆蛋白在controller组中基线水平显著增加。
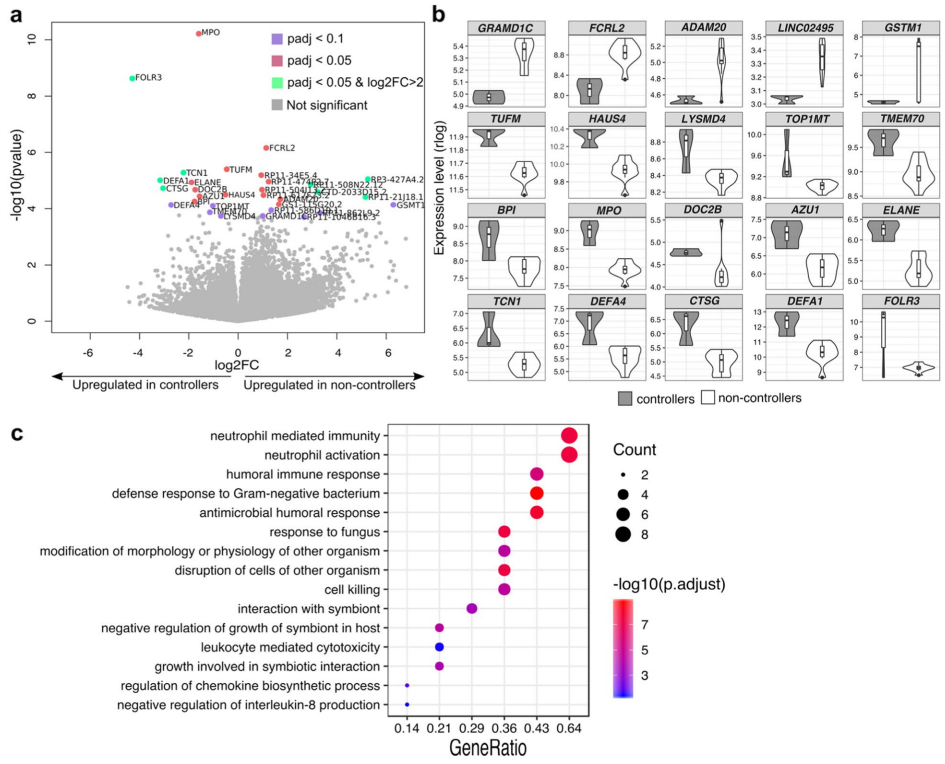
图6 病毒血症控制器中免疫激活和炎症反应水平的基线功能富集
◊ 拟杆菌/梭菌比值、宿主免疫活化转录物、细菌蛋白和HIV-1储库大小之间的整合分析
拟杆菌/梭菌比值与参与炎症反应、免疫系统激活的差异表达基因(DEFA1,DEFA4,TOP1MT等)呈正相关。在对宏基因组、转录组和宏蛋白质组学数据进行综合分析以识别控制者和非控制者之间的区别特征时,拟杆菌和梭菌通过组分被清楚地分开。
虽然拟杆菌聚集并与免疫激活转录物(MPO,AZU1,ELANE,TCN1,DEFA1,BPI,DEF4)以及来自瘤胃球菌,Blautia和Prevotella的蛋白质呈正相关,但梭菌目与这些特征呈负相关。较低分类尺度的多组学相关性,包括病毒库数据证实拟杆菌属物种(B. dorei 和 B. eggerthii)与 HIV-1 DNA 水平呈负相关,而梭菌属(未分类链球菌、D. formicigenerans 和 E. siraeum)的成员与 HIV-1 DNA 和 CA HIV-1 RNA 呈正相关。
相反地,病毒库大小与参与中性粒细胞介导的免疫和宿主防御的基因呈负相关。
这些数据共同表明拟杆菌类群与宿主转录本之间与免疫系统激活呈正相关,进而与HIV-1病毒库呈负相关。然而,梭状芽胞杆菌目内的成员显示出相反的趋势。通过分析比例或单个分类群得出的观察结果,进一步支持了肠道拟杆菌物种、宿主免疫激活和病毒血症控制器中储库大小之间潜在的预先存在的相互作用。
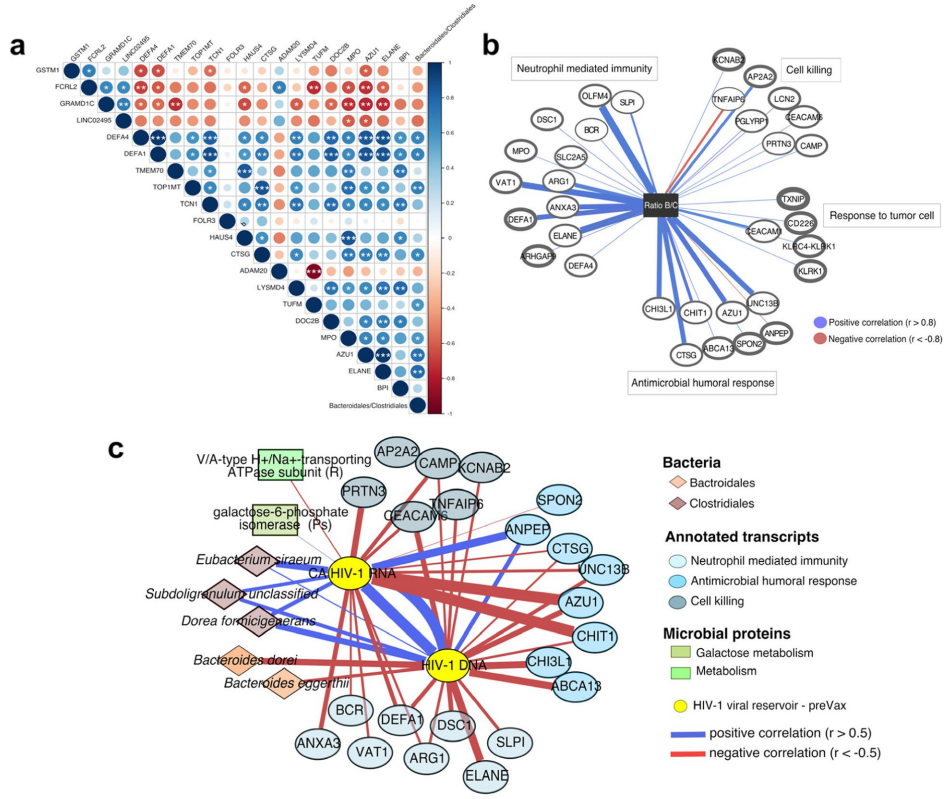
图7 基线肠道微生物特征、免疫激活相关转录物、细菌蛋白和HIV-1库的综合分析
♦ 文章小结
在这项概念验证研究中,一项纵向多“组学”分析将拟杆菌/梭菌比值确定为一种新的肠道微生物组特征,与 HIV-1 储库大小和监测 ART 暂停期间的病毒血症控制相关。
拟杆菌/梭菌比值高的个体表现出与免疫激活相关的基因表达特征,特别是中性粒细胞介导的免疫和抗菌体液反应,这与病毒库大小呈负相关。
研究确定了预先存在的肠道微生物和免疫激活特征作为在没有ART的情况下持续控制HIV-1的潜在预测因子,为未来的治疗策略提供了潜在的目标,并为功能性HIV治愈开辟了新的途径。
文章链接:https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-022-01247-6
编译:向小阳
审核:Leslie
♦ 研究背景及简介
HIV-1治愈的一个主要障碍是病毒库的持久性,其主要指潜伏感染的细胞携带转录沉默、具有复制能力的病毒,这些病毒逃避抗逆转录病毒治疗(ART)以及免疫介导的清除。在未进行ART时,免疫系统通常无法遏制HIV-1复制。
然而,高达10%-20%的受试者在获得HIV-1后第一周内开始ART,在ART中断后可暂时实现HIV-1病毒血症抑制(ATI)。了解ATI后免疫介导的病毒血症控制背后的机制是朝着功能性HIV治愈迈进的关键。有间接证据表明,肠道微生物组也可能有助于免疫介导的HIV-1复制控制,但目前缺乏关于肠道微生物组组成在对治疗策略的反应中的作用以及与ART中断后病毒控制的关系的数据。
2022年,来自IrsiCaixa AIDS研究所等团队的研究者在Microbiome上发表了一篇名为“Gut microbiome signatures linked to HIV-1 reservoir size and viremia control”的文章,该研究针对BCN02临床试验(纳入15名在HIV传播后前6个月内开始ART治疗的具有持续病毒抑制的HIV-1感染者),提出了一项包含宏蛋白组在内的多组学分析,用以确定HIV-1控制感染与肠道微生物的相关性。
结果表明,MAP期间的病毒血症控制者组在疫苗接种前和整个研究干预期间表现出更高的拟杆菌/梭菌比值和较低的微生物基因丰富度。粪便宏蛋白组分析证实基线功能差异主要由梭菌驱动。拟杆菌/梭菌比值以及宿主免疫激活特征与HIV-1储库大小呈负相关。
因此,拟杆菌/梭菌比值是一种新型肠道微生物组特征,与 HIV-1 储库大小和 ART 中断后免疫介导的病毒控制相关。

图1 文章标题
♦ 研究样本
(1)研究样本:粪便、外周血单核细胞PBMC、血浆。其中,粪便样本纵向收集时间节点:pre-Vax:研究之初;MVA1: 第一次疫苗接种后1周;RMD: 罗米地辛每3周给药后一周;MVA2: 第2次疫苗接种后4周;MAP: ART中断后3-34周内;
(2)组学方法:宏基因组、宏蛋白组、转录组、Olink血浆蛋白组。
♦ 研究结果
◊ 微生物多样性和丰度与年龄相关
在本项微生物组子研究中,研究者评估了BCN02临床试验中的13名患者。其中,3名患者在32周MAP(viremic controllers)内持续出现低水平HIV血浆病毒血症(<2000拷贝/mL),9例在MAP(non-controllers)期间出现HIV-1 RNA反弹,另外一名受试者B07不符合MAP条件故被判定为non-controller组。
研究参与者平均年龄是42岁,平均体重为22.0kg/m2。中线基线CD4 T细胞技术为728细胞/mm3, 中位CD4/CD8 T细胞比例为1.4。所有受试者在HIV-1感染后的前3个月内,开始接受triple ART治疗>3年。HIV-1感染前DNA中位基线水平为140拷贝/10^6 CD4+ T细胞,在controller组中明显低于non-controller组(65 vs 165 拷贝/10^6 CD4+ T细胞)。

图2 受试者临床特征
◊ 基线肠道相关拟杆菌/梭菌比值和较低的微生物基因丰度区分病毒血症controller组和non-controller组
病毒血症controller组的拟杆菌/梭菌比值在研究之初和干预阶段一直较高。Controller组表现出较低的β多样性,并且显示出比non-controller组更少的宿主内纵向演变。
虽然两组的肠道微生物组成显著不同,但跨时间点上并没有观察到显著的纵向差异,这表明联合干预并没有显著改变肠道-微生物组成。此外,经代谢途径纵向分析表明,controller组主要富含与脂肪酸生物合成相关的功能,而与甲烷生成和碳水化合物生物合成相关的功能在non-controller组中过表达。
综上,在BCN02研究中开始干预之前,两组之间的差异主要来自常驻微生物群落。

图3 病毒血症controller组中拟杆菌/梭菌比值较高
◊ 病毒血症controller组中拟杆菌/梭菌比值的增加与纵向HIV-1病毒库大小呈负相关
在研究开始之初和干预阶段,拟杆菌/梭菌比值与总CD4+ T细胞显著相关,但与基因丰度相反。
在两项评估中,α多样性与病毒库呈弱正相关,相关性不显著。拟杆菌/梭菌的基线比值与基因丰度成强负相关。
在纵向比较中,controller组倾向于显示较低的病毒库大小。

图4 HIV-1 储库大小与肠道微生物特征之间的关联
◊ 与病毒血症控制相关的不同细菌蛋白特征
使用基线蛋白质组数据(15214种微生物蛋白),跨样品对24个目和69个属进行定量,从宏蛋白质组数据中得出的总拟杆菌和总梭菌目在组间没有差异,但基于梭状芽胞杆菌属的无偏分层聚类显示组间蛋白质差异(p< 0.025)。
研究发现controller组富含来自蓝褐藻、瘤胃球菌的细菌蛋白。

图5 与ART中断后HIV控制相关的基线宏蛋白组学特征
◊ 病毒血症controller组的基线免疫激活和炎症反应转录物增加
在过滤低表达基因后,全PBMC基因表达分析在基线上总共检测到27426个转录本,共鉴定出31个差异表达基因,其中15个和16个在controller组和non-controller组中上调。
GO分析表明,controller组中上调的基因富含与免疫系统激活相关的功能,例如中性粒细胞介导的免疫,白细胞脱颗粒和抗菌体液反应。
此外,一组验证相关的血浆蛋白在controller组中基线水平显著增加。

图6 病毒血症控制器中免疫激活和炎症反应水平的基线功能富集
◊ 拟杆菌/梭菌比值、宿主免疫活化转录物、细菌蛋白和HIV-1储库大小之间的整合分析
拟杆菌/梭菌比值与参与炎症反应、免疫系统激活的差异表达基因(DEFA1,DEFA4,TOP1MT等)呈正相关。在对宏基因组、转录组和宏蛋白质组学数据进行综合分析以识别控制者和非控制者之间的区别特征时,拟杆菌和梭菌通过组分被清楚地分开。
虽然拟杆菌聚集并与免疫激活转录物(MPO,AZU1,ELANE,TCN1,DEFA1,BPI,DEF4)以及来自瘤胃球菌,Blautia和Prevotella的蛋白质呈正相关,但梭菌目与这些特征呈负相关。较低分类尺度的多组学相关性,包括病毒库数据证实拟杆菌属物种(B. dorei 和 B. eggerthii)与 HIV-1 DNA 水平呈负相关,而梭菌属(未分类链球菌、D. formicigenerans 和 E. siraeum)的成员与 HIV-1 DNA 和 CA HIV-1 RNA 呈正相关。
相反地,病毒库大小与参与中性粒细胞介导的免疫和宿主防御的基因呈负相关。
这些数据共同表明拟杆菌类群与宿主转录本之间与免疫系统激活呈正相关,进而与HIV-1病毒库呈负相关。然而,梭状芽胞杆菌目内的成员显示出相反的趋势。通过分析比例或单个分类群得出的观察结果,进一步支持了肠道拟杆菌物种、宿主免疫激活和病毒血症控制器中储库大小之间潜在的预先存在的相互作用。

图7 基线肠道微生物特征、免疫激活相关转录物、细菌蛋白和HIV-1库的综合分析
♦ 文章小结
在这项概念验证研究中,一项纵向多“组学”分析将拟杆菌/梭菌比值确定为一种新的肠道微生物组特征,与 HIV-1 储库大小和监测 ART 暂停期间的病毒血症控制相关。
拟杆菌/梭菌比值高的个体表现出与免疫激活相关的基因表达特征,特别是中性粒细胞介导的免疫和抗菌体液反应,这与病毒库大小呈负相关。
研究确定了预先存在的肠道微生物和免疫激活特征作为在没有ART的情况下持续控制HIV-1的潜在预测因子,为未来的治疗策略提供了潜在的目标,并为功能性HIV治愈开辟了新的途径。
文章链接:https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-022-01247-6
编译:向小阳
审核:Leslie








