2024年10月30日,西湖大学医学院 / 生命科学学院 / 西湖实验室 / 未来产业研究中心郭天南团队和西湖大学生命科学学院 Kiryl D. Piatkevich 团队合作在 Nature Communications 上发表了空间蛋白组学新研究 Spatial proteomics of single cells and organelles on tissue slides using filter-aided expansion proteomics,介绍了滤膜辅助膨胀蛋白组学(FAXP)技术在空间蛋白组学中的应用。
.png)
图1 FAXP文章截图
这是西湖大学科研团队在空间蛋白组学领域的 “进阶版” 成果。
2022年11月,Kiryl D. Piatkevich 和郭天南团队在 Nature Communications 上发表了题为 Spatially resolved proteomics via tissue expansion 的文章,推出了空间蛋白质组学技术 ProteomEx(Proteomics + Expansion,可膨胀的蛋白质组技术)。该技术可将组织嵌入可膨胀的水凝胶,使样品在保持原形态的基础上进行放大,然后进行手动显微切割,继而进行后续的蛋白质组学实验流程。

图2 2022年ProteomEx文章截图
此次新的组织膨胀蛋白质组学分析流程 FAXP (Filter-aided expansion proteomics),在 ProteomEx 原有基础上进行了一系列步骤优化,包括切片制备、组织孵育、组织变性与染色等,以加速样品处理的时间、提高样品制备的通量、提升处理样本分辨率,并使其与临床FFPE组织样本相兼容,首次实现了石蜡切片中单个细胞核形状的深度蛋白质组分析。
该方法结合了基于水凝胶的组织膨胀、滤膜辅助的样本制备流程和基于质谱的蛋白质组学,使得研究者可以在组织水平进行高空间分辨率的蛋白质表达分析,为深入理解组织中蛋白质的表达提供了有力工具,并在结直肠癌(CRC)研究中展示了其应用潜力。
在文章结果部分中,研究团队展示了优化后的FAXP方法在多个方面的优势,包括FFPE切片组织膨胀、滤膜辅助的凝胶内酶解、亚细胞分析和应用于结直肠癌组织中的结果。
结果1:
组织膨胀过程的优化
研究团队首先优化了ProteomEx方法中耗时的几个步骤(如蛋白质锚定、成胶、组织变性和染色),将总处理时间从40.5小时减少至11.2小时,同时提升肽段和蛋白质的检测效率。
为了解决FFPE样本因剧烈变性而导致的膨胀后水凝胶过软的问题,研究人员提高了水凝胶的交联剂比例,使得水凝胶更坚固,实现了更加均匀的组织膨胀。
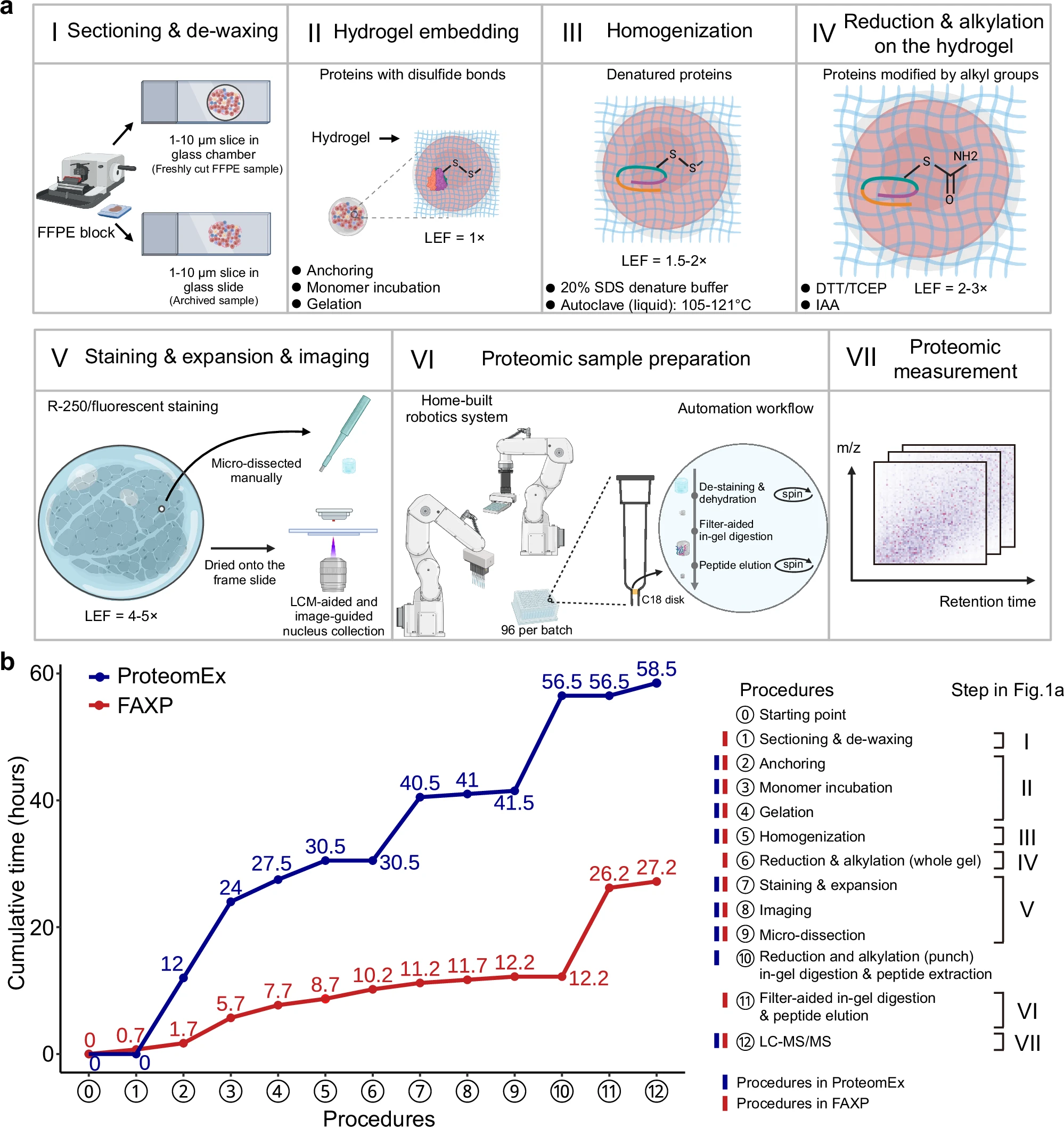
图3 FAXP工作流程及其与ProteomEx的分析对比
FAXP工作流程首先包括对福尔马林固定石蜡包埋(FFPE)组织块的切片和脱腊,然后进行化学处理并嵌入水凝胶。后续步骤包括基于高压灭菌的变性、染色、膨胀、成像以及手动或激光捕获显微切割。从福尔马林固定石蜡包埋 (FFPE) 组织块切片和脱蜡开始,然后进行化学处理并嵌入水凝胶中。后续步骤包括高压釜变性、染色、膨胀、成像以及手动或激光捕获显微切割。样本制备在自动化流程中完成,随后进行蛋白质组学分析。
通过在小鼠肝脏FFPE样本上进行线性膨胀系数和膨胀各向同性分析,结果表明,1小时的蛋白质锚定时间能够实现更一致的微观细胞核和宏观整体组织的膨胀。此项优化使得膨胀过程更高效,且样本的膨胀过程在最大程度上保持了空间信息。
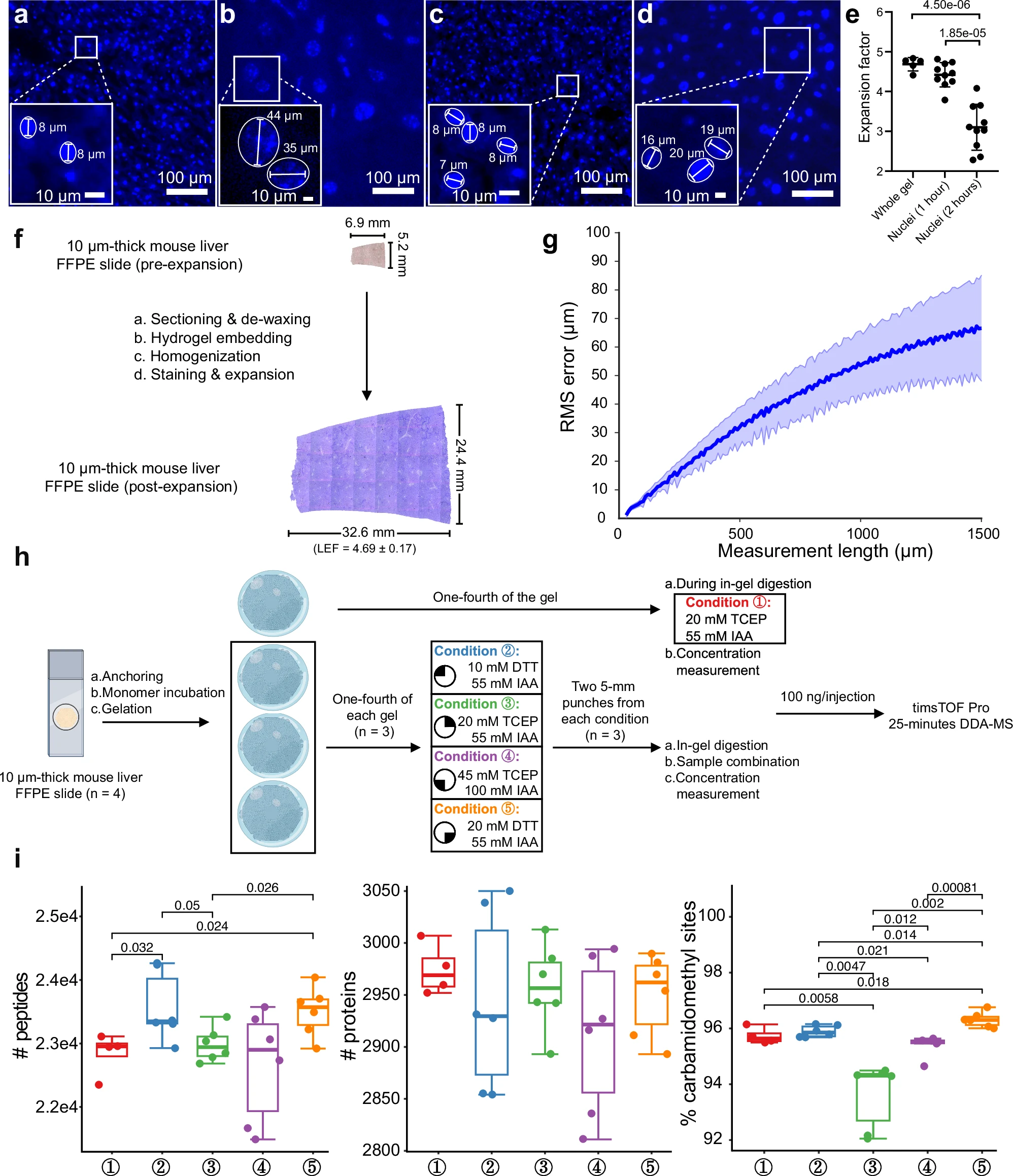
图4 凝胶制备程序的优化及比较蛋白质组学分析
结果2:
滤膜辅助的胶内酶解
ProteomEx方法在横向和体积分辨率上有所限制,主要由于在处理小于1毫米的水凝胶样本时容易因发生样本收缩而导致样本损失。
研究团队开发的 “滤膜辅助的胶内酶解”(in-tip digestion)通过将水凝胶固定在膜上,在质谱分析中显著提高了肽段和蛋白质的检测量(分别增加了96.6%和31.1%)。
这种方法还减少了肽段酶解过程中的漏切率,提高了蛋白质鉴定的覆盖率和准确性。同时,该方法对肽段的长度和疏水性等有更无偏的检测能力,显著增强了样本处理的可控性和蛋白质组覆盖率。
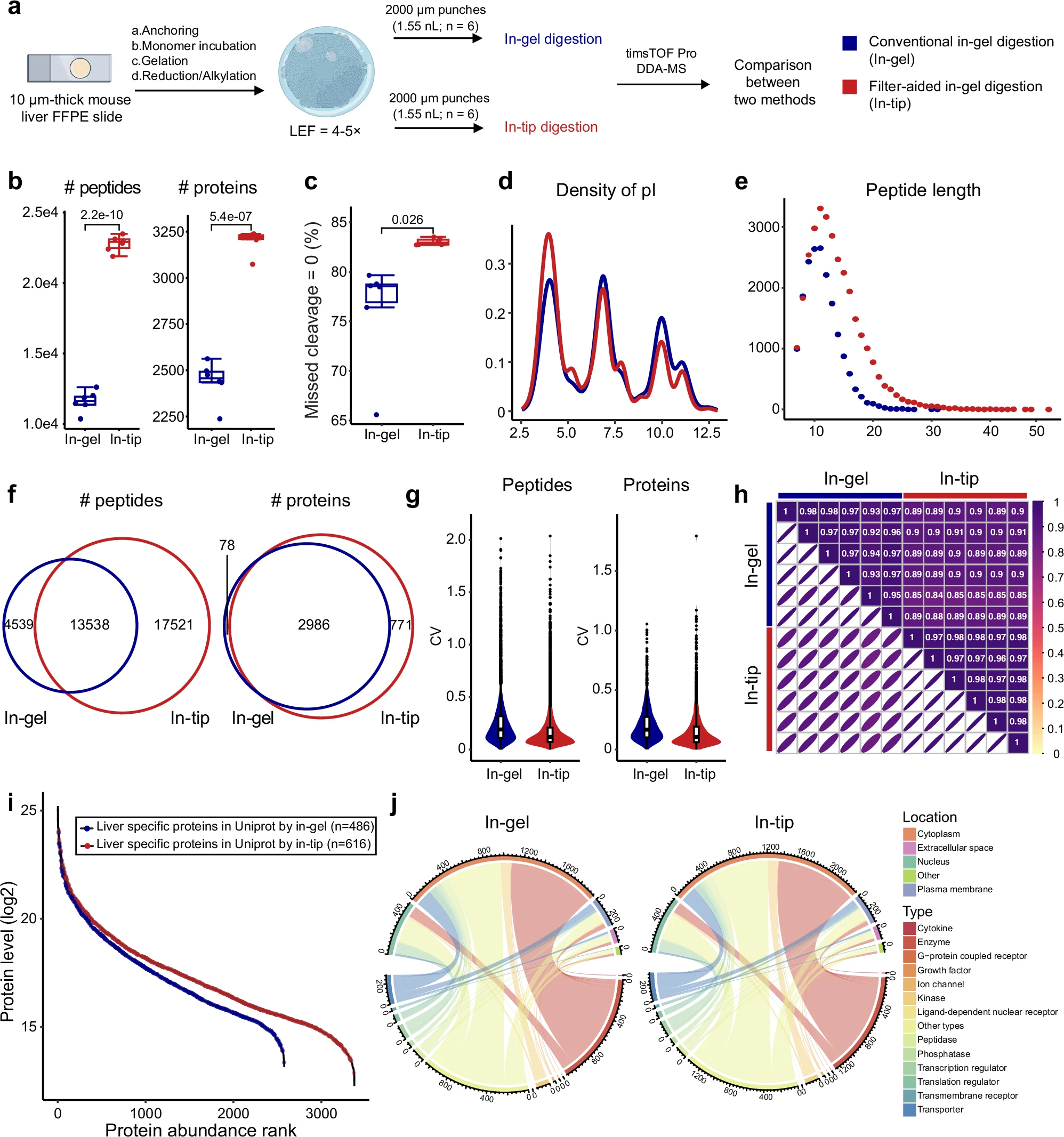
图5 常规胶内酶解与滤膜辅助胶内酶解的比较蛋白质组学分析
结果3:
提高了空间蛋白质组学的通量、分辨率和灵敏度
结合滤膜辅助的枪头内胶内酶解,加速的组织膨胀流程以及自动化样本制备流程,FAXP在蛋白质组覆盖率、样本制备通量、空间分辨率和检测灵敏度方面都有了显著提高。
在针对小鼠肝脏FFPE样本的实验中,新方法在不同组织样本体积上均表现出更高的肽段和蛋白质鉴定率,甚至在体积低至0.042 nL的样本上(相当于横向分辨率为73微米;8个肝细胞)也能有效检测到接近3500个蛋白质。
这些结果表明,FAXP显著提升了ProteomEx的横向和体积分辨率,并能在极微量的样本量下实现高蛋白质鉴定。
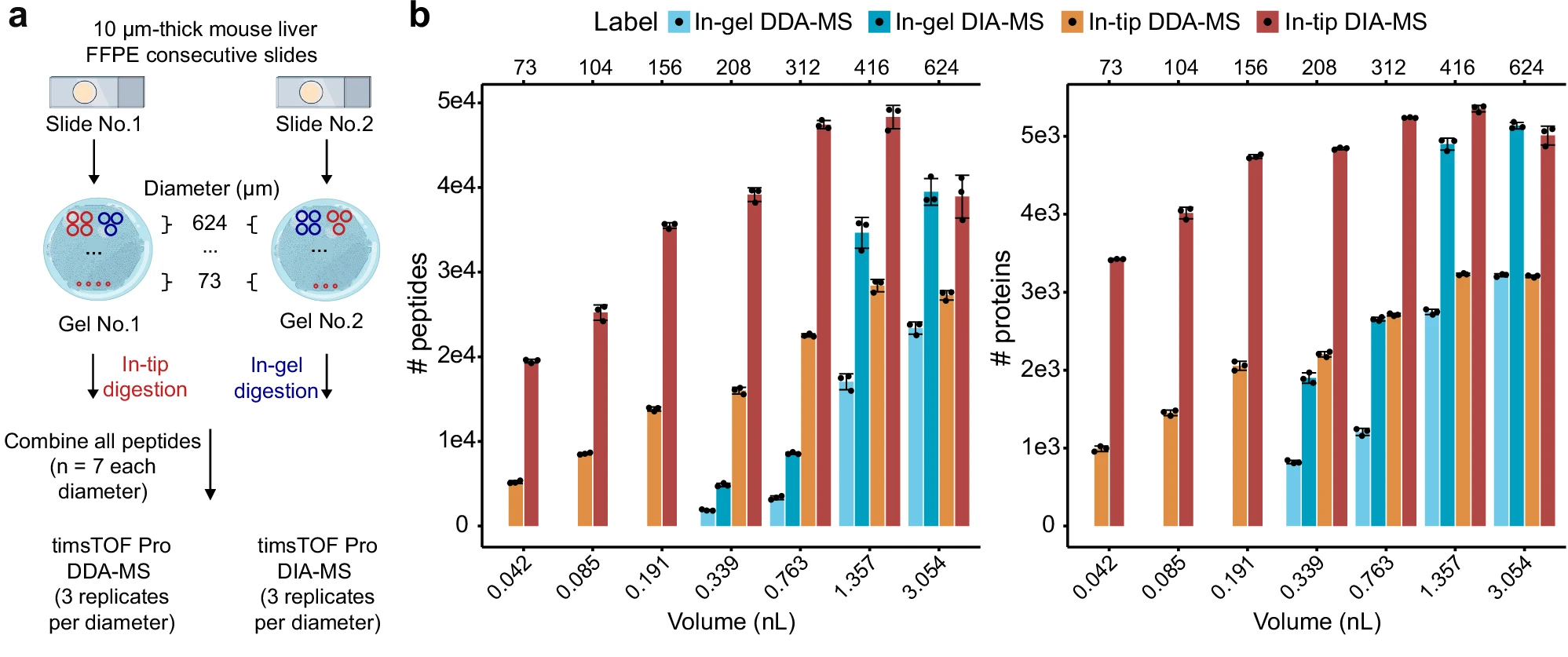
图6 基于不同组织体积的比较蛋白质组学分析
结果4:
将FAXP与LCM结合以研究石蜡切片中细胞核形状的蛋白质组
为了克服在空间蛋白质组学中仅靠激光显微切割(LCM)技术难以从FFPE组织中有效分离单细胞和亚细胞结构的挑战,研究团队采用FAXP技术,将小鼠肝细胞核的直径从约8微米膨胀至约35微米。这种膨胀提高了LCM分离的精度,并显著减少了细胞质污染风险。
通过此方法,研究人员成功分离并分析了单个肝细胞核和单核肝细胞,分别鉴定到了2368种和3312种蛋白质,显示出FAXP在单细胞和亚细胞蛋白质组分析中的应用潜力。
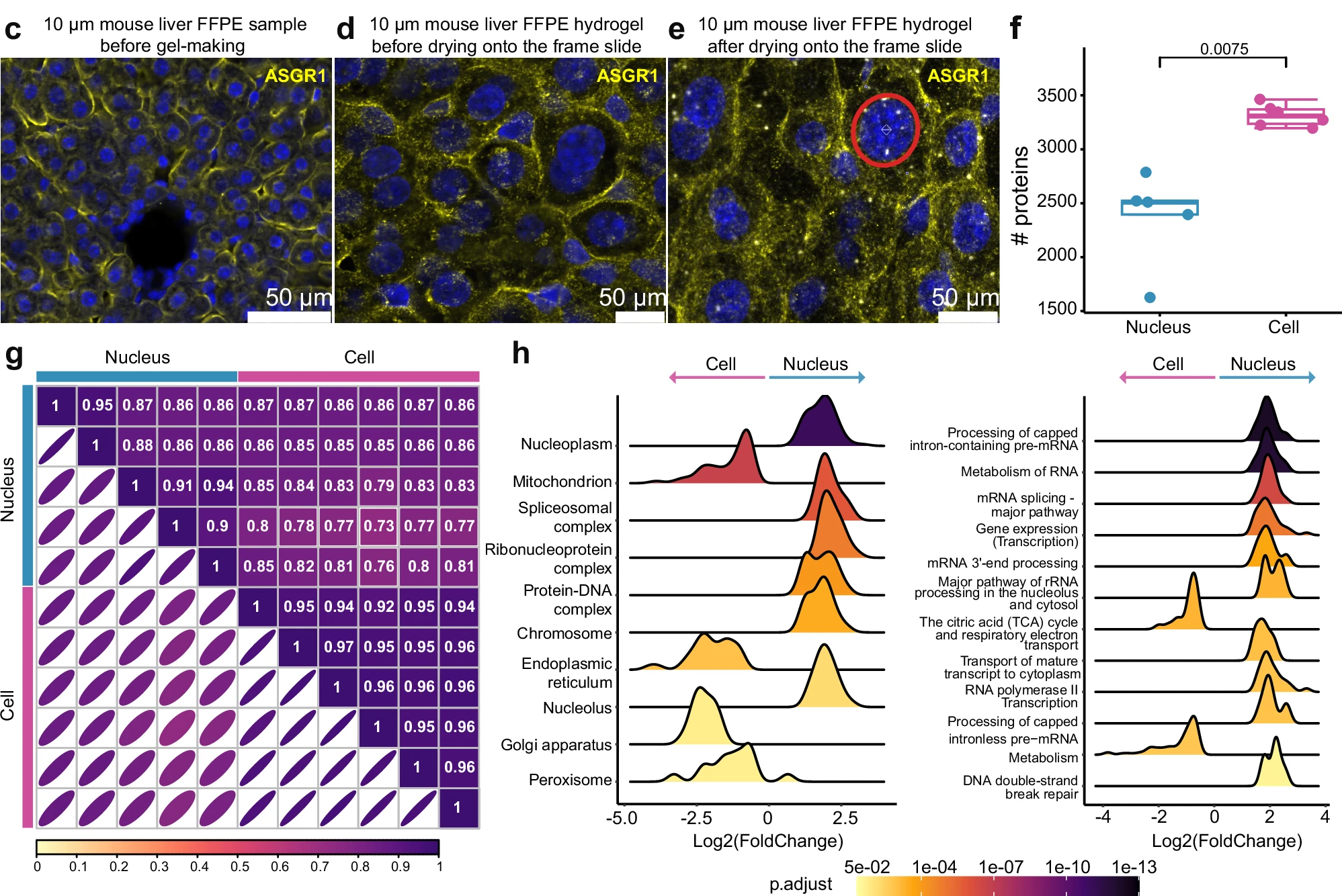
图7 结合FAXP与LCM进行单细胞核蛋白质组分析
结果5:
在结直肠癌(CRC)组织中应用FAXP以分析组织内变异性
在CRC的临床样本中,研究团队利用FAXP方法揭示了不同癌症阶段的蛋白质组变化。
通过对正常组织(N)、低级别不典型增生(L)、高级别不典型增生(H)和癌症区域(C)的蛋白质组进行分析,结果显示随癌症恶行程度加深,鉴定到的蛋白质数量以及通过与癌旁组织比较得到的差异蛋白质的数量逐步增加。这表明FAXP在高通量和高分辨率的条件下能够区分癌症发展过程中组织内的分子差异。
此外,通过蛋白质丰度分析,研究人员发现了CRC不同恶性程度下显著差异的蛋白质,揭示了潜在的临床生物标志物和药物靶点(如CEACAM5)。这些结果验证了FAXP在解析癌症组织内部变异性和鉴别潜在生物标志物方面的可靠性和潜力。
总结
FAXP技术在膨胀蛋白质组学领域实现了针对临床FFPE样本和亚细胞蛋白质组学分析的突破,为复杂样本的高分辨率研究提供了创新方法。通过引入更高效、精细的样本处理流程,FAXP为多种组织样本的空间蛋白质组学分析提供了新方案。尤其是在结直肠癌等临床样本中的应用,展示了该技术在临床研究中的潜力。
文章也指出了FAXP方法目前的局限性,包括污染风险与操作复杂、部分流程仍需手动操作等。
总的来说,FAXP为蛋白质组学研究提供了强有力的工具,尤其适合需要高分辨率和高通量的肿瘤研究和临床病理研究。这种空间蛋白质组学技术有望在未来为多种组织类型的疾病研究提供更丰富的分子信息。
FAXP™️ 组织膨胀蛋白质组学平台

西湖欧米现已推出FAXP™️试剂盒和配套的科研服务,可为广大科研人员提供助力。








