中毒性表皮坏死松解症(TEN)是一种由药物引发的皮肤反应,伴随大面积的表皮脱落,且具有极高的致死率。当前对TEN的治疗主要是支持性治疗,缺乏有效的靶向药物。
10月16日,马克斯·普朗克生物化学研究所 Matthias Mann 团队,联合慕尼黑大学医院、福建医科大学第一附属医院等单位,在 Nature 共同发表了TEN的最新研究 Spatial proteomics identifies JAKi as treatment for a lethal skin disease。
文章通过深度视觉蛋白质组学(DVP)揭示了JAK/STAT信号通路在中毒性表皮坏死松解症中的关键作用,并验证了JAK抑制剂作为潜在疗法的有效性。

图1 论文截图
- 提纲挈领 -
研究利用深度视觉蛋白质组学技术,对中毒性表皮坏死松解症患者的皮肤活检样本进行分析,定量了超过5000种蛋白质,揭示了JAK/STAT信号通路在TEN发病中的关键作用,尤其是干扰素信号和STAT1的磷酸化激活。研究通过体外和体内模型验证了JAK抑制剂(如tofacitinib、baricitinib、abrocitinib和upadacitinib)能够有效降低角质形成细胞的细胞毒性,减少皮肤损伤,并加速上皮恢复。在病例研究中,7位TEN患者接受JAK抑制剂治疗后,均显示出显著的临床改善,表皮再生迅速且无副作用,表明JAK抑制剂有望成为TEN的有效疗法。
结果1:
DVP Workflow
研究使用了深度视觉蛋白质组学(deep visual proteomics,DVP)技术对不同严重程度的皮肤药物反应样本进行了分析,包含轻度(MPR)、严重(TEN、DRESS)患者的FFPE(福尔马林固定和石蜡包埋)以及健康个体的皮肤活检样本。
通过对CD45+免疫细胞和泛角蛋白+角质形成细胞(pan-cytokeratin+ keratinocytes)进行染色,结合机器学习进行细胞分割与激光显微切割,研究人员得以分别提取每种细胞类型的肽段,并使用质谱分析定量大约5000种蛋白质,最终绘制出蛋白质组的空间图谱。这一流程展示了不同参与者中免疫细胞和角质形成细胞的独特蛋白质表达谱。
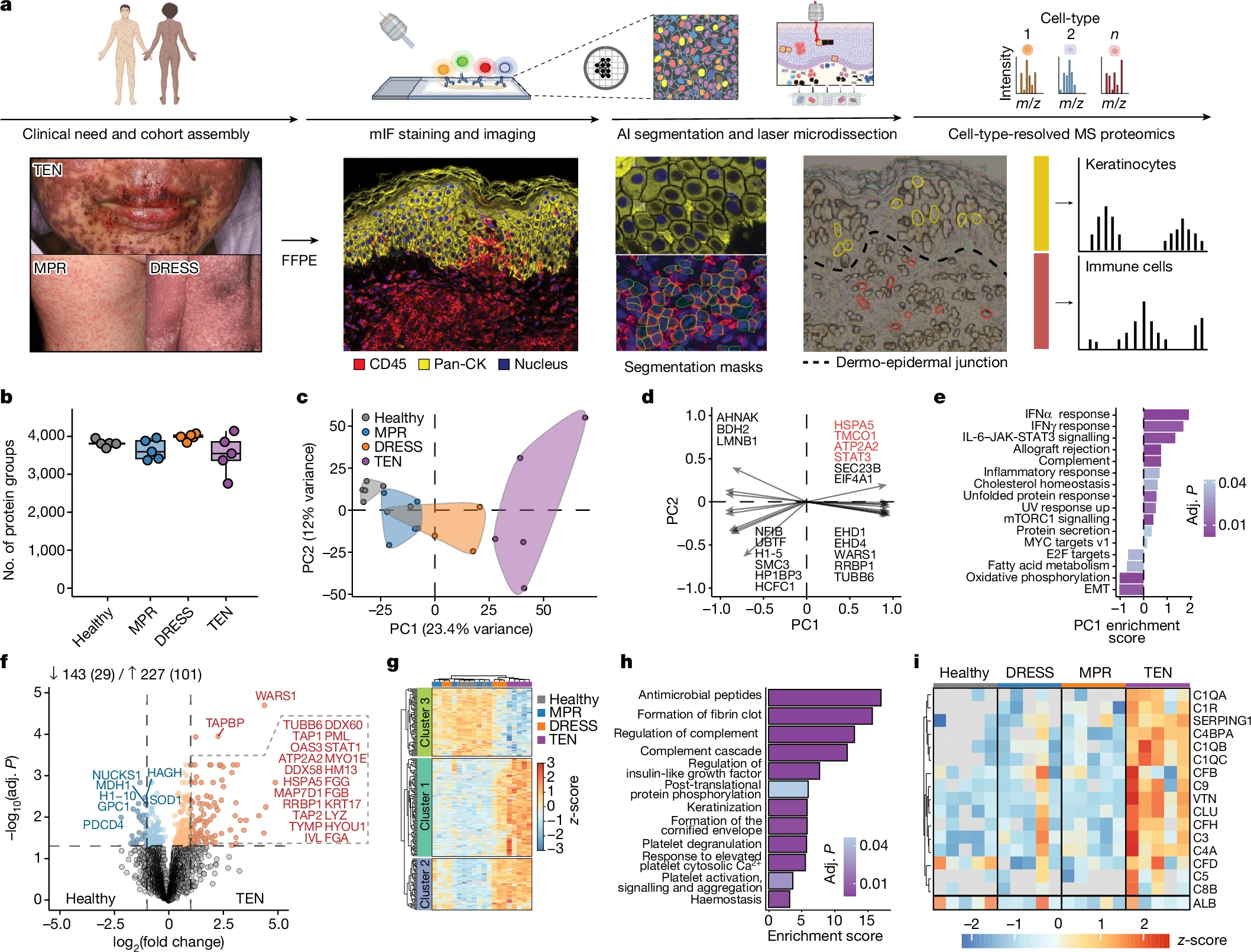
图2 DVP流程及皮肤药物反应中角质形成细胞的细胞类型特异性蛋白质组分析
结果2:
病变角质形成细胞的蛋白质组
研究对药物反应性皮损中的角质形成细胞进行了蛋白表达分析,发现其蛋白质组根据不同类型的皮肤药物不良反应(CADRs)聚类,PC1主成分明显将TEN与其他CADRs及健康个体区分开来,主要与钙稳态和细胞应激反应相关。
通过主成分分析(PCA),研究还发现STAT3和干扰素信号是TEN区分于其他类型的关键因素,且随着疾病严重程度增加,差异表达蛋白(DEPs)也相应增多。
DRESS*中I类主要组织相容性复合体蛋白增加,表明角质形成细胞在抗原呈递中具有重要作用。而在TEN中,抗菌反应相关蛋白和氧化应激标志物的变化可能促进了角质形成细胞凋亡,补体系统的激活进一步加剧了这一过程。
DRESS*:Drug Reaction with Eosinophilia and Systemic Symptoms,药物反应伴嗜酸性粒细胞增多和系统性症状。
结果3:
病变免疫细胞的蛋白质组
不同类型的皮肤药物反应中,免疫细胞的浸润模式差异显著。研究人员分析了CADRs患者皮损中免疫细胞的蛋白质组差异,发现免疫细胞的蛋白质组根据疾病表型聚类,PC1显著区分了DRESS与其他CADRs。DRESS表现出与E2F和MYC相关的高增殖状态;而TEN则表现出显著的干扰素信号,由STAT1主导。
此外,研究还揭示了DRESS患者免疫细胞中特有的蛋白,如EZH2,这是一种在DRESS病理过程中可能扮演关键角色的组蛋白甲基转移酶。
结果4:
巨噬细胞在TEN中的显著作用
尽管早期实验指出了干扰素通路在TEN中的作用,但并未明确具体的免疫细胞亚型。
通过多重数据非依赖性采集(mDIA)流程,研究分析了TEN患者皮肤中稀少的免疫细胞类型,发现巨噬细胞表现出与干扰素通路相关的最高蛋白质表达,尤其是干扰素信号介导蛋白STAT1在巨噬细胞中的表达显著高于其他免疫细胞。与CD8+细胞毒性T细胞相比,巨噬细胞富集了更多的髓系特异性标志物和干扰素驱动蛋白。
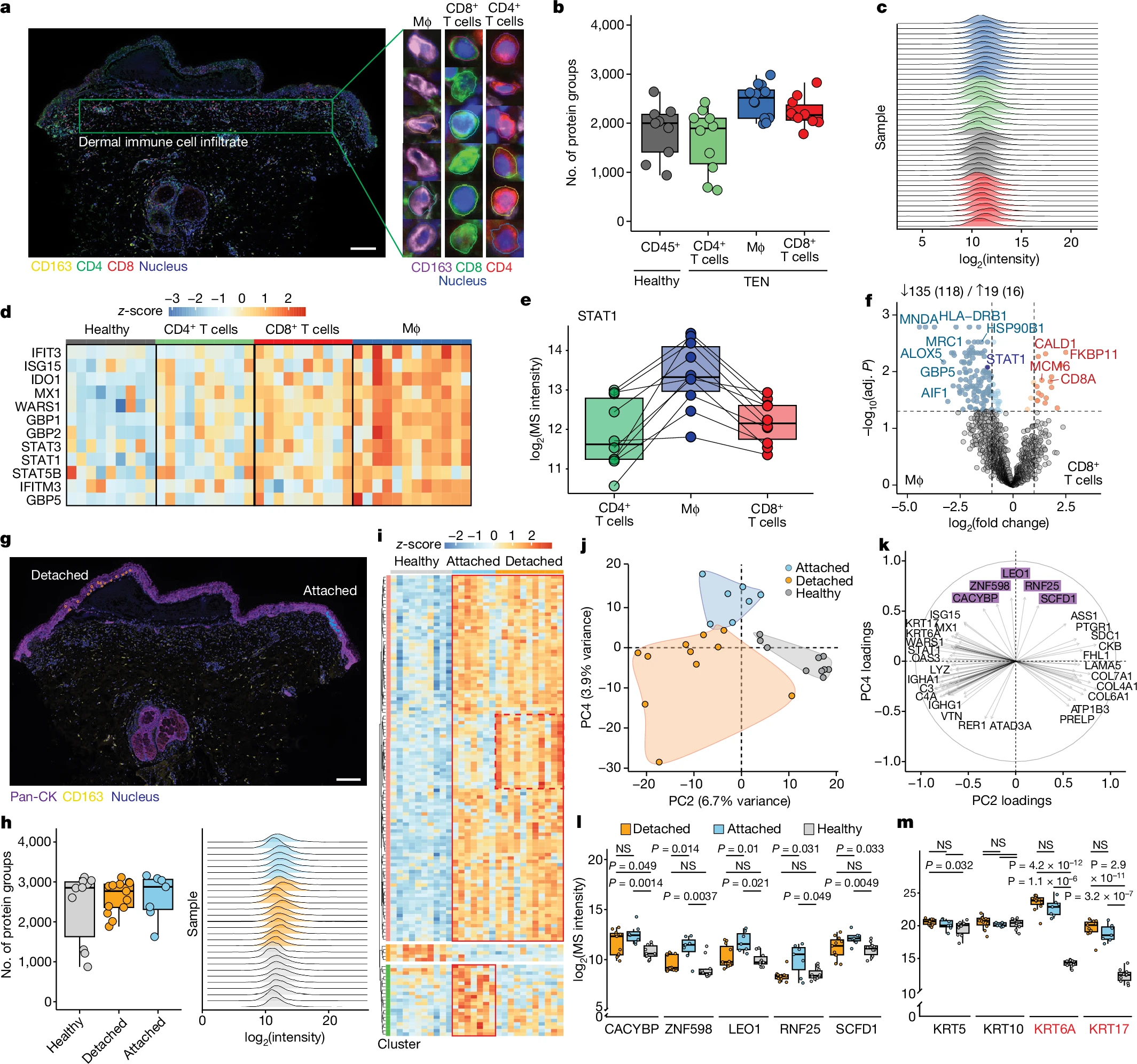
图3 TEN中免疫细胞亚型的空间蛋白质组分析
结果5:
TEN患者表皮剥脱的空间蛋白质组
研究还分析了TEN患者中已脱落的角质形成细胞(blister roof)和未脱落的角质形成细胞(blister side)。发现炎症通路在这两类角质形成细胞中已经高度活跃,尤其是补体系统和炎症级联反应,这表明TEN中临近水泡的健康角质形成细胞可能已经处于炎症激活状态。
虽然未剥脱和已剥脱角质形成细胞之间的蛋白质差异较细微,但足以根据空间位置区分它们。研究还识别出5种与未剥脱和已剥脱细胞相关的蛋白质,可能代表早期的蛋白质组变化。
结果6:
JAK/STAT通路在TEN中的高活性
研究发现,角质形成细胞和免疫细胞中多种蛋白质(如WARS1、STAT1等)在TEN中显著上调,表明干扰素信号通过JAK/STAT通路被激活。
STAT1和STAT3在TEN的免疫细胞和角质形成细胞中均有上调,并且STAT1的磷酸化进一步验证了其在信号传导中的作用。
研究还通过靶向转录组学和蛋白质组分析,确认了JAK/STAT通路的激活是TEN的主要致病机制。
结果7:
JAK/STAT靶向治疗的效果
通过体外和体内模型,研究验证了JAK抑制剂对TEN的治疗效果。在体外模型中,JAK抑制剂tofacitinib以剂量依赖方式抑制了角质形成细胞的细胞毒性作用。
在小鼠模型中,口服JAK抑制剂(tofacitinib 或 baricitinib)显著减少了皮肤的炎症和表皮损伤,恢复了表皮厚度,减少了细胞凋亡,并加速了表皮恢复。JAK1特异性抑制剂abrocitinib和upadacitinib也表现出显著疗效。
此外,JAK抑制剂在人体化小鼠模型中同样有效,显著减少了药物引起的眼部炎症和上皮细胞死亡,显示出JAK抑制剂在TEN治疗中的潜力。
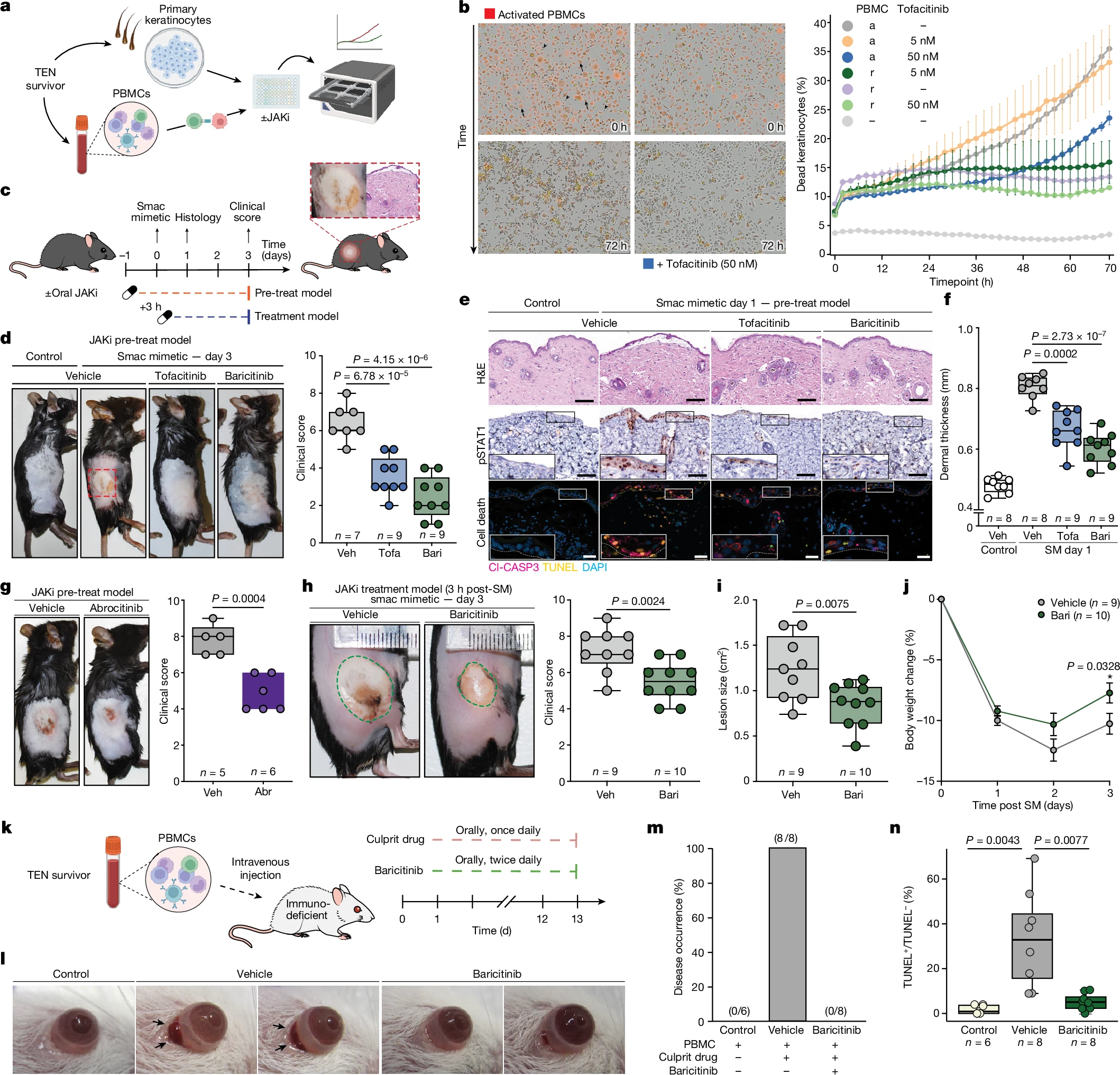
图4 TJAK/STAT抑制可在体外和体内降低TEN的严重程度
结果8:
JAK抑制剂治疗TEN的临床效果
研究团队对7名TEN或SJS*-TEN综合征患者进行了JAKi治疗,其中一名59岁的患者在接受抗癌药物后发展为TEN,表皮脱落面积达35%。在使用JAK1抑制剂abrocitinib后,患者的病情在2天内停止恶化,16天后达到95%的皮肤再生,最终完全康复。
所有7名患者在治疗后30天内均无副作用,且磷酸化STAT1水平显著降低。这些临床数据显示了JAK1或泛JAK抑制剂在TEN治疗中的潜力。
SJS*:Stevens–Johnson syndrome,史蒂芬斯-强森症候群,多型红斑的一种,能影响表皮细胞死亡。
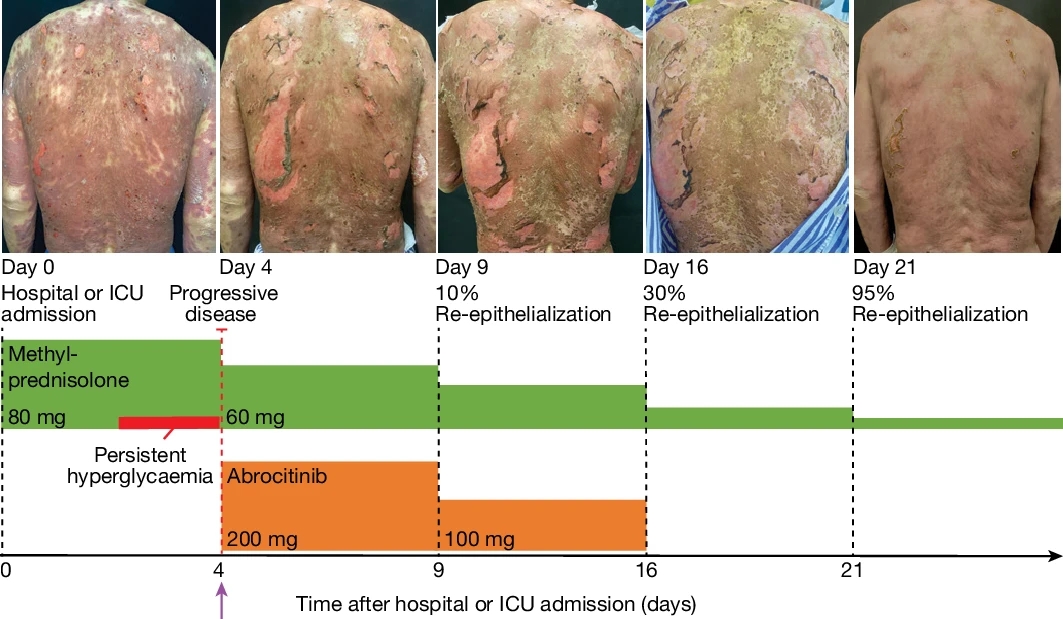
图5 JAK/STAT抑制对TEN患者的有益作用。一名与癌症治疗相关的TEN(SCORTEN评分4分)患者的病程。在高剂量静脉注射methylprednisolone治疗期间,病情持续进展,患者出现持久性高血糖。第4天开始使用JAK1抑制剂abrocitinib进行救援治疗,48小时内病情进展明显停止,4天内出现初步的皮肤再上皮化。
总 结
研究通过空间蛋白质组学分析,首次明确了JAK/STAT通路在TEN中的致病作用,并在临床前和临床研究中验证了JAK抑制剂的治疗潜力。文章的结果部分展示了从蛋白质表达分析到靶向治疗验证的完整链条,提供了有力的证据支持JAK抑制剂作为TEN治疗的新策略。
研究展示了空间蛋白组学技术在病理分析中的巨大潜力。通过对不同细胞类型的分子机制进行精确绘图,该技术有望在未来的炎症性或肿瘤性疾病治疗中找到新的药物靶点和治疗方法。